Вопрос 1. Исторический очерк.
Мысль о существовании атомов как неделимых частиц материи возникла ещё в древности; идеи атомизма впервые были высказаны древнегреческими мыслителями Демокритом и Эпикуром.
Впервые предположение о сложном строении атома выдвинул Прауг (1816 г.). Согласно его гипотезе, атомы химических элементов являются различными соединениями атомов наиболее легкого элемента – водорода. Эта теория оставалась в забвении вплоть до конца XIX и начала ХХ столетий, совпавших с важными открытиями в физике и химии.
Четкие определения понятий атома и молекулы были даны С. Каниццаро в 1858 г. и приняты в 1860 г. на съезде химиков в Карлсруэ. В 1833 г. при исследовании явления электролиза М. Фарадей установил, что ток в растворе электролита это упорядоченное движение заряженных частиц – ионов, и определил минимальный заряд иона, который был назван элементарным электрическим зарядом. Его приближенное значение e =1,60·10–19 Кл. Был сделан вывод о существовании внутри атомов электрических зарядов. В 1869 г. Д. Менделеев открыл периодический закон химических элементов. Представления физической атомистики легли в основу развития молекулярной физики, в том числе кинетической теории газов (середина 19 века), в классической статистической физике (вторая половина 19 в., Р. Клаузиус, Дж. Максвелл, Л. Больцман, Дж. У. Гибс).
В 19 в. наряду с химическими свойствами атомов были изучены их оптические свойства. Было установлено, что каждый элемент обладает характерным оптическим спектром; был открыт спектральный анализ (немецкие физики Г. Кирхгоф и Р. Бунзен, 1860 г.). Важным свидетельством сложной структуры атомов явились спектроскопические исследования, которые привели к открытию линейчатых спектров атомов. В начале XIX века были открыты дискретные спектральные линии в излучении атомов водорода в видимой части спектра и впоследствии были установлены математические закономерности, связывающие длины волн этих линий (И. Бальмер, 1885 г.).
Немецкий физик К.Рентген в 1896 г. обнаружил рентгеновские лучи,афранцузский физик А. Беккерель (1896 г.)– явление радиоактивности. Английский физик Дж. Томсон (1897 г.) открыл электрон, оценил его заряд и массу. Он же в 1903 г. предложил первую модель атома, составной частью которого являются электроны.
Возникновение современной атомной физики связано именно с открытиями электрона и радиоактивности.
В 1903 г. английские ученые Э. Резерфорд и Ф. Содди, изучая явление радиоактивности, объяснили его как процесс химического превращения элементов, т.е. эти физики использовали предположение о делимости и изменяемости атомов и установили закон радиоактивных превращений. В 1903 г. Э. Резерфорд доказал, что 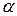 - лучи состоят из положительно заряженных частиц. За исследования по превращению химических элементов он получил Нобелевскую премию по химии (1908г).
- лучи состоят из положительно заряженных частиц. За исследования по превращению химических элементов он получил Нобелевскую премию по химии (1908г).
Важнейшим этапом развития атомной физики стало открытие Э. Резерфордом в 1911 г. атомного ядра и рассмотрение атома на основе квантовых представлений Н. Бором в 1913 г.
В начале 20-го века были обнаружены две, казалось, не связанные между собой группы явлений, свидетельствующих о неприменимости механики Ньютона и классической электродинамики к процессам взаимодействия света с веществом и к процессам, происходящим в атоме. Первая группа явлений связана с установлением на опыте двойственной природы света – дуализма света, вторая – с невозможностью объяснить на основе классических представлений существование устойчивых атомов, а также их оптические спектры. Установление связи между этими группами явлений и попытки их объяснения привели к открытию законов квантовой механики.
Как уже отмечалось выше, впервые квантовые представления были введены в 1900 г. М. Планком в работе, посвящённой теории теплового излучения тел. Существующая к тому времени теория теплового излучения, построенная на основе классической электродинамики и статистической физики, приводила к выводу о невозможности термодинамического равновесия между излучением и веществом, т.к. вся энергия должна перейти в излучение.
Планк разрешил это противоречие и получил результаты, прекрасно согласующиеся с опытом, предположив, что свет испускается не непрерывно (как это следовало из классической теории излучения), а определёнными дискретными порциями энергии – квантами. Величина такого кванта пропорциональна частоте света ν и равна ε=hν. Попытки обосновать гипотезу Планка в рамках классической физики оказались безуспешными.
Развивая идею Планка, Эйнштейн предположил, что свет не только испускается и поглощается, но распространяется квантами, т.е. что дискретность присуща самому свету: свет состоит из отдельных порций – световых квантов, названных позднее фотонами. На основании квантовых представлений Эйнштейн объяснил установленные на опыте закономерности фотоэффекта (1905 г.), которые противоречили классической теории света. В том же году Эйнштейн сформулировал закон взаимосвязи массы и энергии.
В 1913 году Н.Бором была создана первая квантовая теория атома водорода: введено понятие главного квантового числа, показаны условия существования стационарных состояний атома, условия расчета частот излучения и дана формулировка уровней энергии атома. В этом же году опытами Дж. Франка – Г. Герца получено экспериментальное доказательство существования дискретных уровней энергии атомов. В 1914 г. былообъяснено возникновение рентгеновских спектров излучения, исходя из представлений об электронных оболочках атома, которые создают вокруг ядра последовательные слои (В. Коссель).
В 1923 предложен принцип запрета Паули - один из важнейших принципов современной теоретической физики, введён магнитный момент ядер, объяснена сверхтонкая структура спектральных линий в рамках гипотезы ядерного спина.
Доказательство корпускулярного характера света было получено в 1922 г. А. Комптоном, показавшим экспериментально, что при рассеянии рентгеновских лучей свободными электронами происходит изменение их частоты в соответствии с законами упругого столкновения двух частиц – фотона и электрона. Кинематика столкновения определяется законами сохранения энергии и импульса, причём фотону наряду с энергией следует приписать импульс P=h/λ=hν/c. Энергия и импульс фотона связаны соотношением ε=сP, справедливым в релятивистской механике для частицы с нулевой массой покоя. Таким образом, было доказано, что наряду с известными волновыми свойствами (проявляющимися в интерференции, дифракции и поляризации) свет обладает и корпускулярными свойствами. В этом состоит дуализм света, его корпускулярно-волновая природа. Дуализм содержится уже в формуле ε=hν, не позволяющей выбрать какую-либо одну из двух концепций: энергия ε характеризует частицу, а частота ν является характеристикой волны. Возникло формальное логическое противоречие: для объяснения одних явлений необходимо считать, что свет имеет волновую природу, а для объяснения других – корпускулярную.
В 1924 г. де Бройль, пытаясь найти объяснение постулированным в 1913 г. Н. Бором условиям квантования атомных орбит, выдвинул гипотезу о всеобщности корпускулярно-волнового дуализма. Согласно де Бройлю, каждой частице, независимо от её природы, следует поставить в соответствие волну, длина которой λ связана с импульсом частицы р соотношением λ=h/p. По этой гипотезе не только фотоны, но и все «обыкновенные частицы» (электроны, протоны и др.) обладают волновыми свойствами, которые, в частности, должны проявляться в дифракции частиц. В 1927 г. К. Дэвиссон и Л. Джермер впервые наблюдали дифракцию электронов. Позднее волновые свойства были обнаружены экспериментально и у других частиц. В 1926 г. Э. Шредингер предложил уравнение, описывающее поведение таких «волн» во внешних силовых полях, а М. Борн дал им статистическую вероятностную интерпретацию. Так возникла волновая механика. Волновое уравнение Шредингера является основным уравнением нерелятивистской квантовой механики.
Для объяснения устойчивости атомов Бор предположил, что излучение энергии атомом подчиняется квантовым законам, т.е. происходит дискретными порциями. Он постулировал, что из всех орбит, допускаемых ньютоновской механикой для движения электрона в электрическом поле атомного ядра, реально осуществляются лишь те, которые удовлетворяют определённым условиям квантования, требующим, чтобы величина момента импульса классической орбиты была целым кратным постоянной Планка h. Такие орбиты были названы стационарными. Им соответствуют определённые уровни энергии.
Далее Бор постулировал, что при движении по стационарным орбитам электрон не испускает световых волн. Излучение происходит лишь при переходе электрона с одной стационарной орбиты на другую, т.е. с одного уровня энергии Ei на другой, с меньшей энергией Ek, и при этом возникает квант света с энергией hν=Ei - Ek. Так объяснялся линейчатый спектр атома. Исходя из этих постулатов, Бор получил правильную формулу для частот спектральных линий атома водорода и водородоподобных атомов,
охватывающую совокупность открытых ранее эмпирических формул. При этом численное значение постоянной Ридберга, которое Бор выразил через фундаментальные константы m, e, h (m и е – масса и заряд электрона), прекрасно совпадало с опытными данными. Размеры атома в теории Бора также выражались через фундаментальные константы: радиус нижней боровской орбиты a=h2/me2≈0,5·10-10 м совпадал с экспериментальными оценками размеров атома.
Таким образом, Бор, используя квантовую постоянную h, отражающую дуализм света, показал, что эта величина определяет также и движение электронов в атоме. Впоследствии стало ясно, что этот вывод – одно из следствий универсальности корпускулярно-волнового дуализма. Существование дискретных уровней энергии в атомах было непосредственно подтверждено опытами Франка-Герца.
Рассмотрение, согласно модельной теории атома Бора, движения электронов в стационарных состояниях по законам классической механики при дополнительных условиях квантования позволило самому Бору, А. Зоммерфельду и др. учёным объяснить закономерности в оптических и рентгеновских спектрах и дать физическое истолкование периодического закона элементов.
Успех теории Бора был достигнут за счёт нарушения логической целостности классической теории: с одной стороны использовалась ньютоновская механика, с другой – привлекались чуждые ей искусственные правила квантования. Кроме того, теория Бора оказалась не в состоянии объяснить движение электронов в сложных атомах (даже в атоме гелия), возникновение химической связи между атомами, приводящей к образованию молекул, и др. «Полуклассическая» теория Бора не могла также ответить на вопрос, как движется электрон при переходе с одного уровня энергии на другой.
Дальнейшая разработка вопросов теории атома привела к утверждению, что движение электрона в атоме нельзя описывать в терминах классической механики как движение по определённой траектории, или орбите, что вопрос о движении электрона между стационарными орбитами несовместим с характером законов, определяющих поведение электронов в атоме, и что необходима новая теория, в которую входили бы только величины, относящиеся к начальному и конечному стационарным состояниям атома.
Окончательное формирование квантовой механики как последовательной теории с ясными физическими основами произошло после работы Гейзенберга (1927 г.), в которой было сформулировано соотношение неопределённостей – важнейшее соотношение, освещающее физический смысл уравнений квантовой механики, её связь с классической механикой и ряд других принципиальных вопросов.
Детальный анализ спектров атомов привёл к представлению о том, что электрону кроме заряда и массы должна быть приписана ещё одна внутренняя характеристика – спин. Важную роль сыграл открытый Паули принцип запрета, имеющий фундаментальное значение в теории атомов, молекул, ядер, твёрдых тел.
В течение короткого времени квантовая механика была с успехом применена для описания широкого круга явлений. Были созданы теории атомных спектров, строения молекул, химической связи, периодической
системы элементов, ферромагнетизма, электропроводности металлов. Нерелятивистская квантовая механика развивалась в основном в направлении охвата разнообразных конкретных задач физики атомов, молекул, твёрдых тел, а также совершенствования математического аппарата и разработки количественных методов решения различных задач.
В дальнейшем на основе квантово-механического подхода была объяснена сверхтонкая структура спектров (В. Паули), открыта сверхтонкая структура спектральных линий атомных спектров (А. Теренин, Л. Добрецов, Г.Шюллер), открыто обменное взаимодействие (П. Дирак и В. Гейзенберг).
Соединение квантовой механики с теорией относительности привело к установлению квантово-механического уравнения, описывающего релятивистский электрон, и к созданию релятивистской квантовой механики (П. Дирак).
Таким образом, рассмотрев исторически, как совершенствовались наши представления об атоме, видим, что атом действительно представляет собой сложное образование. Спектры испускания и поглощения атомов еще раз подтверждают, что атом не является неделимой частицей, а обладает некоторой внутренней сложной структурой.
С одной стороны, "устойчивость" атома объясняет устойчивость различных видов вещества, непревращаемость химических элементов в естественных условиях, например при обычных на Земле температурах и давлениях. С другой стороны, изменение его свойств и состояний при изменении внешних условий, в которых он существует, объясняет возможность образования более сложных систем с новыми характеристиками.
Дальнейшее развитие физики атомов и молекул неразрывно связано со становлением квантовой механики, в рамках которой удалось понять и объединить все многообразие экспериментальных данных, относящихся к вопросу о строении и свойствах большинства атомов и молекул.
Вопрос 2. Классическая модель атома по Резерфорду.
Модели атома. 1903 году Дж. Томсон, предложил модель атома, согласно которой атом представляет собой сферу, равномерно заполненную положительным электричеством. Электроны погружены в эту среду и взаимодействуют с элементами этой среды по закону Кулона (рис. 19.1, а). Согласно этой модели атом в целом нейтрален: суммарный заряд сферы и заряда электронов равен нулю. Спектр такого атома должен был быть сложным, но никоим образом не линейчатым, что противоречило экспериментальным данным. По модели Томсона колеблющийся электрон (осциллятор) может испускать электромагнитную волну. При отклонении электрона от положения равновесия возникают силы, которые стремятся возвратить его в положение равновесия. Благодаря этому возникают колебания электрона, которые обусловливают излучение атома.
Была предложена также модель атома, изображенная на рис. 19.1,б: атом состоял из сферы, в центре которой находилось положительно заряженное ядро, а вокруг него располагались электроны. Однако и эта модель не смогла объяснить результаты экспериментов.
Наиболее известна планетарная модель атома, предложенная английским физиком Э. Резерфордом (рис. 19.1, в).
Первые эксперименты по изучению строения атома были выполнены
Э. Резерфордом и его сотрудниками Э.Марсденом и Х.Гейгером в 1909–1911 годах. Резерфорд предложил применить зондирование атома с помощью
α-частиц, которые возникают при радиоактивном распаде радия и некоторых других элементов.
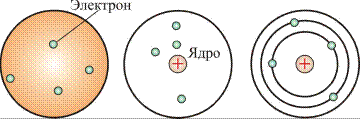
а) б) в)
Рис. 19.1
Эти опыты стали возможны благодаря открытию явления радиоактивности, при котором в результате естественного радиоактивного распада тяжелых элементов выделяются 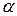 -частицы, имеющие положительный заряд, равный заряду двух электронов, масса
-частицы, имеющие положительный заряд, равный заряду двух электронов, масса 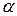 -частицы в 4 раза больше массы атома водорода, т.е. они являются ионами атома гелия
-частицы в 4 раза больше массы атома водорода, т.е. они являются ионами атома гелия 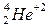 . Энергия
. Энергия 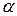 -частиц, испускаемых различными тяжелыми химическими элементами, изменяется от
-частиц, испускаемых различными тяжелыми химическими элементами, изменяется от 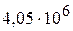 эВ для урана до
эВ для урана до 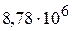 эВ для тория. Масса α-частиц примерно в 7300 раз больше массы электрона, а положительный заряд равен удвоенному элементарному заряду. В этих опытах использовались α-частицы с кинетической энергией 5 МэВ, что соответствовало их скорости около
эВ для тория. Масса α-частиц примерно в 7300 раз больше массы электрона, а положительный заряд равен удвоенному элементарному заряду. В этих опытах использовались α-частицы с кинетической энергией 5 МэВ, что соответствовало их скорости около 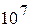 м/с.
м/с.
Эти частицы бомбардировали фольги из тяжелых металлов (золото, серебро, медь и др.). Электроны, входящие в состав атомов, вследствие малой массы не изменяют траекторию α-частицы. Рассеяние, то есть изменение направления движения α-частиц, может вызвать только тяжелая положительно заряженная часть атома.
Цель опытов Резерфорда состояла в том, чтобы экспериментально проверить основные положения модели атома, предложенной Томсоном.
Схема опыта Резерфорда по рассеянию α-частиц показана на рис. 19.2.
Здесь K – свинцовый контейнер с радиоактивным веществом, Э – экран, покрытый сернистым цинком, Ф – золотая фольга, M – микроскоп. От радиоактивного источника, заключенного в свинцовый контейнер,
α-частицы направлялись на тонкую металлическую фольгу. Толщина фольги составляла 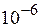 м (1 мкм), что эквивалентно примерно 400 слоям из атомов золота. Рассеянные фольгой α-частицы попадали на экран, покрытый слоем кристаллов сульфида цинка, способных светиться под ударами быстрых заряженных частиц. Сцинтилляции (вспышки) на экране наблюдались глазом
м (1 мкм), что эквивалентно примерно 400 слоям из атомов золота. Рассеянные фольгой α-частицы попадали на экран, покрытый слоем кристаллов сульфида цинка, способных светиться под ударами быстрых заряженных частиц. Сцинтилляции (вспышки) на экране наблюдались глазом
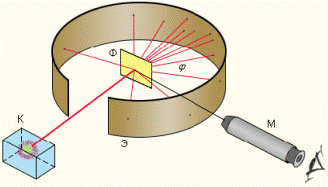
Рис. 19.2
с помощью микроскопа. Микроскоп и связанный с ним экран можно было вращать вокруг оси, проходящей через центр фольги. Т.е. можно было всегда измерить угол отклонения α-частиц от прямолинейной траектории движения. Весь прибор помещался в вакуум, чтобы α-частицы не рассеивались при столкновении с молекулами воздуха.
Наблюдения рассеянных α-частиц в опыте Резерфорда можно было проводить под различными углами φ к первоначальному направлению пучка. Было обнаружено, что большинство α-частиц проходило через тонкий слой металла, практически не испытывая отклонения. Однако небольшая часть частиц все же отклонялась на значительные углы, превышающие 30°. Очень редкие α-частицы (приблизительно одна на десять тысяч) испытывали отклонение на углы, близкие к 180°. Этот результат был неожиданным, т.к. находился в противоречии с моделью атома Томсона, согласно которой положительный заряд распределён по всему объёму атома. При таком распределении положительный заряд не может создать сильное электрическое поле, способное отбросить α-частицы назад. Электрическое поле однородного заряженного шара максимально на его поверхности и убывает до нуля по мере приближения к центру шара. Если бы радиус шара, в котором сосредоточен весь положительный заряд атома, уменьшился в n раз, то максимальная сила отталкивания, действующая на α-частицу по закону Кулона, возросла бы в n2 раз. Тогда при достаточно большом значении n α-частицы могли бы испытать рассеяние на большие углы вплоть до 180°. Эти соображения привели Резерфорда к выводу, что атом почти пустой, и весь его положительный заряд сосредоточен в малом объёме, имеющем размеры порядка 10-14 м. Эту часть атома Резерфорд назвал атомным ядром. Электроны, по мнению Резерфорда, движутся вокруг ядра с размерами порядка 10–14 м. Так возникла ядерная модель атома (рис. 19.1, в).
На основании полученных результатов Резерфорд, учитывая, что электроны атома не могут существенно влиять на рассеяние относительно тяжелых и быстрых 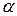 -частиц, сделал выводы, которые были положены в основу планетарной (ядерной) модели атомов:
-частиц, сделал выводы, которые были положены в основу планетарной (ядерной) модели атомов:
1) существует ядро, в котором сосредоточена вся масса атома и весь его положительный заряд, причем размеры ядра значительно меньше, чем размер самого атома;
2) электроны, которые входят в состав атома, движутся вокруг ядра по круговым орбитам.
Исходя из этих двух предпосылок и предполагая, что взаимодействие между налетающей 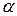 -частицей и положительно заряженным ядром определяется кулоновскими силами, Резерфорд установил, что атомные ядра имеют размеры
-частицей и положительно заряженным ядром определяется кулоновскими силами, Резерфорд установил, что атомные ядра имеют размеры 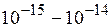 м, т.е. они в
м, т.е. они в 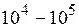 раз меньше размеров атомов. Ядро занимает только 10–12 часть полного объёма атома, но содержит весьположительный заряд и не менее 99,95 % его массы. Вещество, составляющее ядро атома, имеет колоссальную плотность ρ≈1017 кг/м3. Заряд ядра должен быть равен суммарному заряду всех электронов, входящих в состав атома. Впоследствии удалось установить, что если заряд электрона принять за единицу, то заряд ядра в точности равен номеру данного элемента в таблице Менделеева. Величина положительного электрического заряда атомного ядра Z определяется количеством протонов в ядре (и, следовательно, количеством электронов в атомных оболочках), которое совпадает с порядковым номером элемента в периодической таблице. Заряд равен Zе, где е=1,602·10-19 Кл – абсолютная величина элементарного электрического заряда. Заряд определяет химические свойства всех изотопов данного элемента.
раз меньше размеров атомов. Ядро занимает только 10–12 часть полного объёма атома, но содержит весьположительный заряд и не менее 99,95 % его массы. Вещество, составляющее ядро атома, имеет колоссальную плотность ρ≈1017 кг/м3. Заряд ядра должен быть равен суммарному заряду всех электронов, входящих в состав атома. Впоследствии удалось установить, что если заряд электрона принять за единицу, то заряд ядра в точности равен номеру данного элемента в таблице Менделеева. Величина положительного электрического заряда атомного ядра Z определяется количеством протонов в ядре (и, следовательно, количеством электронов в атомных оболочках), которое совпадает с порядковым номером элемента в периодической таблице. Заряд равен Zе, где е=1,602·10-19 Кл – абсолютная величина элементарного электрического заряда. Заряд определяет химические свойства всех изотопов данного элемента.
В 1911 Резерфорд, используя закон Кулона, получил формулу
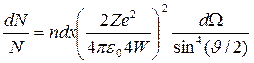 , (19.1)
, (19.1)
где N – количество α-частиц, падающих в единицу времени на рассеиватель; dN – количество рассеянных в единицу времени α-частиц в телесном угле dΩ под углом θ; Ze и n – заряд ядер рассеивателя и их концентрация; dx − толщина слоя фольги; W − энергия α-частиц.
Прямые опыты по измерению заряда ядер на основе формулы Резерфорда были выполнены Чедвиком в 1920 году. Схема опыта Чедвика приведена на рис. 19.3.
Рассеиватель в виде кольца, (заштрихованого на рис. 19.3, размещался соосно и на равных расстояниях между источником И и детектором α-частиц Д. При измерении количества dN рассеянных α-частиц отверстие в кольце закрывалось экраном, который поглощал прямой пучок α-частиц из источника в детектор.
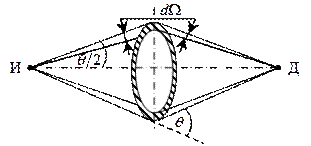
Рис. 19.3
Детектор регистрировал только α-частицы, рассеянные в телесном угле dΩ под углом θ к падающему пучку α-частиц. Затем кольцо перекрывалось экраном с отверстием, и измерялась плотность тока α-частиц в точке расположения детектора. По полученным данным, рассчитывали
количество N α-частиц, падающих на кольцо в единицу времени. Таким образом, если известна энергия α- частиц, испускаемых источником, без труда определялась величина Z в формуле (19.1).
Формула Резерфорда позволила объяснить экспериментальные результаты по рассеянию α-частиц на тяжелых ядрах , что привело к открытию атомного ядра и созданию ядерной модели атома.
Модель атома, предложенная Резерфордом, напоминает Солнечную систему. Именно поэтому модель Резерфорда получила название планетарной модели атома.Эта модель стала значительным шагом на пути к современным представлениям о строении атома. Лежащее в ее основе понятие атомного ядра, в котором сосредоточены весь положительный заряд атома и практически вся его масса, сохранило свое значение до настоящего времени.
Однако, в отличие от планетарной модели Солнечной системы, планетарная модель атома оказывается внутренне противоречивой с точки зрения классической физики. И это, прежде всего, связано с наличием у электрона заряда. Согласно законам классической электродинамики вращающийся вокруг ядра электрон, как и любая ускоренно движущаяся заряженная частица, будет излучать электромагнитные волны. Спектр такого излучения должен быть непрерывным, то есть содержать электромагнитные волны с любой длиной волны. Уже этот вывод противоречит линейчатости спектров излучения атомов, наблюдаемой на опыте.
Кроме того, непрерывное излучение уменьшает кинетическую энергию электрона. Поэтому, за счет излучения радиус орбиты движущегося электрона обязан уменьшаться, и, в конце концов, электрон должен упасть на ядро, как показывают оценки, за время 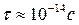 . Однако в действительности атом водорода является устойчивой и «долгоживущей» электромеханической системой. Иными словами, планетарная модель атома с точки зрения классической физики оказывается неустойчивой.
. Однако в действительности атом водорода является устойчивой и «долгоживущей» электромеханической системой. Иными словами, планетарная модель атома с точки зрения классической физики оказывается неустойчивой.
Дата добавления: 2017-10-04; просмотров: 1694;











