Вопрос 5. Виды спектров. Спектральный анализ.
Спектральный состав излучения атомов различных веществ весьма разнообразен. Тем не менее, все спектры можно разделить на три сильно отличающихся друг от друга типа.
Непрерывные (сплошные) спектры.В непрерывном спектре излучения (рис. 19.12.1) представлены волны всех длин. В спектре нет разрывов, и на экране спектрографа можно видеть сплошную разноцветную полосу с плавным переходом от одного цвета к другому.
Непрерывные (или сплошные) спектры дают тела, находящиеся в твердом или жидком состоянии, а также сильно сжатые газы. Для получения непрерывного спектра нужно нагреть тело до высокой температуры. Характер непрерывного спектра и сам факт его существования определяются не только свойствами отдельных излучающих атомов, но и в сильной степени зависят от взаимодействия атомов друг с другом. Непрерывный спектр дает также высокотемпературная плазма. Электромагнитные волны излучаются плазмой в основном при столкновении электронов с ионами.
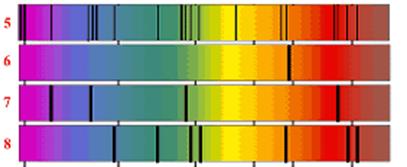
Линейчатые спектры.Линейчатые спектры излучения (Рис. 19.13.2,3,4) представляют собой набор цветных линий различной яркости, разделенных широкими темными полосами. Наличие линейчатого спектра означает, что вещество излучает свет только вполне определенных длин волн (точнее, в определенных очень узких спектральных интервалах). Каждая из линий имеет конечную ширину. Линейчатые спектры дают все вещества в газообразном атомарном (но не в молекулярном) состоянии. Изолированные атомы химического элемента излучают строго определенные длины волн, характерные данному химическому элементу. Природа линейчатых спектров объясняется тем, что у атомов конкретного вещества существуют только ему свойственные стационарные состояния со своим набором энергетических уровней.
Обычно для наблюдения линейчатых спектров используют свечение паров вещества в пламени или свечение газового разряда в трубке, наполненной исследуемым газом. При увеличении плотности атомарного газа отдельные спектральные линии расширяются и, при очень большой плотности газа, когда взаимодействие атомов становится существенным, эти линии перекрывают друг друга, образуя непрерывный спектр.
Полосатые спектры. Полосатые спектры излучения состоят из отдельных полос, разделенных темными промежутками (Рис 19.14: а, б).
С помощью очень хорошего спектрального прибора можно обнаружить, что каждая полоса представляет собой совокупность большого числа очень тесно расположенных линий. В отличие от линейчатых спектров полосатые спектры создаются не атомами, а молекулами, не связанными или слабо связанными друг с другом.
Спектры поглощения. Если пропускать белый свет сквозь холодный, неизлучающий газ, то на фоне непрерывного спектра источника появляются темные линии поглощения (Рис. 19.15). Газ поглощает наиболее интенсивно свет как раз тех длин волн, которые он испускает в сильно нагретом состоянии. Темные линии на фоне непрерывного спектра - это линиипоглощения, образующие в совокупности спектр поглощения. Спектры поглощения могут быть непрерывными, линейчатыми и полосатыми.
Атом, поглощая свет, переходит из основного состояния в возбужденное, причем для возбуждения атомов пригодны строго определенные кванты энергии 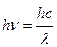 , соответствующие данному газу. Поэтому газ поглощает из непрерывного спектра те самые кванты света, которые может излучать сам.
, соответствующие данному газу. Поэтому газ поглощает из непрерывного спектра те самые кванты света, которые может излучать сам.
Оптические спектры
Спектры испускания
400 450 500 550 600 700 (нм)

(1−сплошной; линейчатые: 2−натрия; 3−водорода; 4−гелия)
Рис. 19.13
Полосатые спектры
а) 
Cпектр испускания паров молекул иода
б) 
Спектр испускания угольной дуги (полосы молекул CN и С2)
Рис.19.14
Спектры поглощения
400 450 500 550 600 700 (нм)
(5−солнечный; линейчатые: 6−натрия; 7−водорода; 8−гелия)
Рис. 19.15
На рисунках 19.13 и 19.15 сопоставлены спектры испускания и поглощения разреженных паров натрия, водорода и гелия.
Изучая спектры испускания и поглощения атомов, еще в 19 веке физики пришли к выводу, что атом не является неделимой частицей, а обладает некоторой внутренней сложной структурой.
Использование линейчатых спектров лежит в основе спектрального анализа– метода исследования химического состава веществ по их спектрам. Отдельные линии в спектрах различных элементов могут совпадать, но в целом спектр каждого элемента является его индивидуальной характеристикой. Спектральный анализ сыграл большую роль в науке. Например, в спектре Солнца (1814) были открыты фраунгоферовы темные линии, происхождение которых объясняется следующим образом. Солнце, являясь раскаленным газовым шаром (Т ~ 6000 °С), испускает сплошной спектр. Солнечные лучи проходят через атмосферу Солнца (солнечную корону, температура которой ~(2000–3000) °С. Корона поглощает из сплошного спектра излучение определенной частоты, а на Земле регистрируется солнечный спектр поглощения (рис. 19.15,5), по которому можно определить, какие химические элементы присутствуют в короне Солнца. По спектрам поглощения на Солнце были обнаружены все земные элементы, а также неизвестный ранее элемент, который назвали гелий. Через 26 лет (1894) открыли гелий на Земле. Благодаря спектральному анализу на Земле было открыто еще 25 химических элементов.
Более того, спектральный анализ Солнца и звезд показал, что входящие в их состав химические элементы имеются и на Земле, т.е. вещество Вселенной состоит из одного и того же набора элементов.
Из-за своей сравнительной простоты и универсальности спектральный анализ является основным методом контроля состава вещества в металлургии и машиностроении. С помощью спектрального анализа определяют химический состав руд и минералов как по спектрам испускания, так и по спектрам поглощения. Состав сложных смесей анализируется по молекулярным спектрам.
При определенных условиях методами спектрального анализа можно не только определить химический состав компонент, но и их количественное содержание.
Контрольные вопросы:
1. Приведите формулу Бальмера и поясните ее физический смысл.
2. Почему из различных серий спектральных линий атома водорода первой была изучена серия Бальмера?
3. Какие серии спектральных линий вы знаете?
4. Чему равна частота излучения атома водорода, соответствующая коротковолновой границе серии Брэкета?
5. Нарисуйте и поясните схему энергетических уровней атома водорода.
6. Приведите схему опыта Резерфорда и поясните ее.
7. Что такое постулаты Бора? Каков их физический смысл? Как с их помощью объясняется линейчатый спектр атома?
8. Что такое стационарные орбиты? Как рассчитываются их радиусы?
9. Почему ядерная модель атома по Резерфорду оказалась несостоятельной?
10. Приведите схему опыта Франка и Герца и вольт-амперную характеристику, описывающую результат этого эксперимента.
11. Какие постулаты Бора были подтверждены опытами Франка и Герца?
12. Какие основные выводы можно сделать на основании опытов Франка и Герца?
13. Пользуясь моделью Бора, укажите спектральные линии, которые могут возникнуть при переходе атома водорода из состояний с n=3 и с n= 4.
14. Назовите виды спектров испускания. Охарактеризуйте условия получения каждого вида спектров.
15. Что такое спектр поглощения? Условия получения спектровпоглощения.
16. Что лежит в основе спектрального анализа?
Дата добавления: 2017-10-04; просмотров: 9552;











