Опыт 1. Зависимость скорости реакции от концентрации.
Зависимость скорости реакции от концентрации реагирующих веществ удобно исследовать на примере взаимодействия тиосульфата натрия с серной кислотой:
Na2S2O3 + H2SO4 = Na2SO4 + SO2 + H2O + S¯
Выделяющаяся сера вызывает помутнение раствора, которое становится заметным только после того, как концентрация серы достигает определенной величины. Время от начала реакции
(началом реакции считается момент сливания растворов) до заметного помутнения раствора зависит от скорости реакции: чем больше скорость, тем меньше время.
Приготовить три раствора различной концентрации. Для этого взять три сухие пробирки, внести в первую 4 капли 1 н раствора тиосульфата натрия и восемь капель воды, во вторую 8 капель 1 н раствора тиосульфата натрия и 4 капли воды, в третью 12 – капель
1н раствора тиосульфата натрия. Первую и вторую пробирки осторожно встряхнуть.
Добавить в первую пробирку одну каплю 0,5 н раствора серной кислоты, одновременно включить секундомер. Измерить время от момента добавления кислоты до появления в растворе заметной опалесценции. То же проделать со второй и третьей пробирками.
Таблица 1
| № № | Количество капель | Концентрация С Na2S2O3 | Промежуток времени от начала отсчета до появления мути, t, с | Скорость
реакции
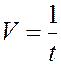
| ||
| Na2S2O3 | H2O | H2SO4 | ||||
| С | ||||||
| 2С | ||||||
| 3С |
Результаты опыта занести в таблицу1. Построить график зависимости скорости 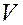 (ось ординат) от концентрации С (ось абсцисс). Согласно закону действующих масс зависимость скорости от концентрации должна выражаться прямой линией, проходящей через начало координат. Сделать вывод о зависимости скорости реакции от концентрации.
(ось ординат) от концентрации С (ось абсцисс). Согласно закону действующих масс зависимость скорости от концентрации должна выражаться прямой линией, проходящей через начало координат. Сделать вывод о зависимости скорости реакции от концентрации.
Дата добавления: 2021-09-07; просмотров: 1105;











