Опыт 4. Влияние величины поверхности соприкосновения
Веществ на скорость гетерогенной реакции.
а) Взаимодействие карбоната кальция с соляной кислотой.
Приготовить два небольших приблизительно одинаковых кусочка мела. Один из них растереть пестиком на листе бумаги и пересыпать в коническую пробирку, второй поместить в другую пробирку. В обе пробирки одновременно добавить по 15 капель соляной кислоты плотностью 1,19 г/мл. В какой из пробирок реакция протекает быстрее и почему? Написать уравнение реакции.
б) Взаимодействие нитрата свинца с иодидом калия.
Несколько кристаллов иодида калия и нитрата свинца поместить в две сухие ступки и тщательно растереть пестиком. Приготовить две сухие пробирки. В одну из них положить по несколько кристаллов нитрата свинца и иодида калия, в другую насыпать приблизительно такое же количество солей, растертых в порошок. Для перемешивания реагирующих веществ обе пробирки энергично встряхнуть, закрыв отверстие. Поставить пробирки в штатив и наблюдать образование иодида свинца.
Отметить влияние поверхности соприкосновения реагирующих веществ на скорость реакции. Написать уравнение реакции.
КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАЧИ
1. Что называется скоростью химической реакции?
2. Какие реакции относятся к гомогенным и какие к гетерогенным, привести примеры?
3. Чем характеризуется скорость гомогенной реакции и в каких единицах она измеряется?
4. От каких факторов зависит скорость гомогенной химической реакции?
5. От каких факторов зависит скорость химической реакции в гетерогенных системах?
6. Сформулировать закон действующих масс. Написать выражение скорости реакций, протекающих между: а) азотом и кислородом; б) оксидом азота (II) и кислородом; б) диоксидом углерода и раскаленным углем.
7. Реакция между оксидом азота (II) и хлором протекает по уравнению 2NO (г) + Cl2 (г) ® 2NOCl (г). Как изменится скорость реакции при увеличении: а) концентрации Cl2 в два раза;
б) концентрации обоих веществ (NO и Cl2) в два раза?
8. Во сколько раз следует увеличить концентрацию оксида углерода в системе 2СО (г) ® СО2 (г) + С (т), чтобы скорость реакции увеличилась в четыре раза?
9. Реакция идет по уравнению H2 (г) + I2 (г) ® 2HI (г). Константа скорости этой реакции при 508 0С равна 0,16. Исходные концентрации реагирующих веществ были:
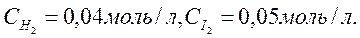
Вычислить начальную скорость реакции и скорость ее, когда концентрация водорода стала равной 0,03 моль/л.  Ответ: 3,2 ×10 –4; 1,92 × 10 –4.
Ответ: 3,2 ×10 –4; 1,92 × 10 –4.
10. Как и почему изменяется скорость химической реакции при изменении температуры?
11. Что называют энергией активации?
12. Какие вещества называются катализаторами? Какое влияние и почему оказывает катализатор на скорость химической реакции?
13. Во сколько раз увеличится константа скорости химической реакции при повышении температуры на 40 0, если g = 3,2?
14. На сколько градусов следует повысить температуру системы, чтобы скорость протекающей в ней реакции возросла в 30 раз
(g = 2,5).
15. При повышении температуры на 50 0 скорость реакции возросла в1200 раз. Вычислить g.
Дата добавления: 2021-09-07; просмотров: 681;











