ТЕОРЕТИЧЕСКОЕ ОБОСНОВАНИЕ
Большинство реакций являются обратимыми, т.е. они протекают в противоположных направлениях и не идут до конца, так как продукты реакции, взаимодействуя между собой, вновь дают исходные вещества. Обратимость реакции отмечается знаком двух стрелок, направленных в противоположные стороны ®.
Cостояние обратимого процесса при котором скорости прямой и обратной реакции равны называется химическим равновесием (Vпр= Vобр). Если в системе наступило химическое равновесие, то изменение изобарно-изотермического потенциала (энергии Гиббса) происходить не будет, т.е. DG = 0.
Для гомогенной обратимой реакции
aA + bB ® dD + mM (1)
в состоянии равновесия выполняется соотношение
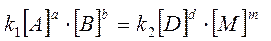
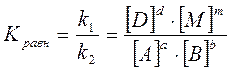 (2)
(2)
где [А], [В], [D], [М] равновесные концентрации, то есть концентрации веществ в момент равновесия ( их обозначают при помощи квадратных скобок); a, b, c, e – стехиометрические коэффициенты при веществах в уравнении реакции; Kравн – константа химического равновесия, заменяющая собой отношение двух постоянных величин k1 и k2.
Чем больше Kравн , тем больше концентрация конечных продуктов в момент равновесия. Она показывает, во сколько раз прямая реакция идет быстрее обратной при одинаковой температуре и концентрациях, равных единице. Уравнение (2) есть выражение закона действующих масс применительно к обратимым реакциям. Его формулировка такова: при обратимых реакциях равновесие наступает тогда, когда произведение концентраций образующихся веществ, деленное на произведение концентраций веществ, вступающих в реакцию, станет равным некоторой постоянной для данной реакции величине при данной температуре.
Для реакций между газами молярные концентрации пропорциональны парциальным давлениям Р. В этом случае выражение константы равновесия для реакции (1) можно записать в виде 
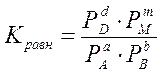
Часто пользуются отрицательным десятичным логарифмом численного значения Kравн и обозначают его рК (показатель константы).
рК = - lgKравн.
Применение рК позволяет упростить расчеты и запись характеристики системы ( например, если Кравн = 1,74 ×10 –5, то рК = 4,76).
Константа равновесия связана с изменением стандартного изобарно-изотермического потенциала химической реакции DG0 соотношением
DG0 = - RT lnКравн
или
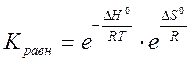 .
.
Из этих уравнений следует, что Кравн очень чувствительна к изменению температуры. Влияние на Кравн природы реагирующих веществ определяет ее зависимость от энтальпийного и энтропийного факторов. От концентрации реагентов и давления ( если оно не очень высокое) константа равновесия не зависит.
Зная равновесные концентрации, легко вычислить константу равновесия и исходные концентрации реагирующих веществ. Например, равновесие реакции, протекающей по уравнению
H2 + I2 ® 2HI
установилось при следующих концентрациях участвующих в ней веществ: [H2] = 0,004 моль/л, [I2] = 0,025 моль/л, [ HI] = 0,08 моль/л.
Определить константу равновесия и исходные концентрации водорода и йода.
Для решения задачи находим значение константы равновесия для данной реакции по уравнению
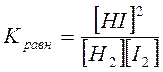
Подставив значения концентраций реагирующих веществ при равновесии, получим
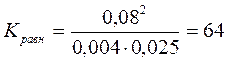
Уравнение реакции показывает, что из одной молекулы H2 и одной молекулы I2 образуется две молекулы HI. Следовательно, для образования 0,08 моль HI требуется 0,04 моль H2 и 0,04 моль I2.
Таким образом, исходные концентрации
[H2]исх = 0,004 + 0,04 = 0,044 моль/л,
[I2]исх = 0,025 + 0,04 = 0,065 моль/л.
Необходимо отметить, что твердые вещества не входят в выражение константы равновесия по той же причине, что и при рассмотрении скорости реакции.
Например: 3Fe (к) + 4H2O (пар) ® Fe3O4 (к) + 4H2 (г)
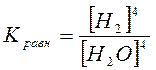
В состоянии равновесия система может оставаться до тех пор, пока не изменятся внешние условия: концентрация, температура, а для газов – давление. Направление смещение положения химического равновесия (таблица 1) определяется принципом Ле-Шателье: изменение одного из условий (температуры, концентрации, давления), при которых система находится в состоянии химического равновесия, вызывает смещение равновесия в направлении той реакции, которая противодействует произведенному изменению.
Таблица 1 Влияние изменения условий на положение химического равновесия
| Изменение условий, при которых система находится в состоянии химического равновесия | Изменение cкорости прямой и обратной реакции в начальный момент | Направление смещения положения равновесия |
| повышается Температура понижается | В большей степени возрастает скорость эндотермической реакции В большей степени понижается скорость эндотермической реакции | В сторону эндотермической реакции В сторону экзотермической реакции |
| повышается Давление понижается | В большей степени возрастает скорость реакции, протекающей с уменьшением числа молей газообразных веществ В большей степени понижается скорость реакции, протекающей с уменьшением числа молей газообразных веществ | В сторону уменьшения числа молей газообразных веществ в системе В сторону увеличения числа молей газообразных веществ в системе |
| повышается Концентрация понижается | Возрастает скорость реакции, по которой вводимое вещество расходуется Уменьшается скорость реакции, где реагентом является вещество, концентрация которого уменьшается | В сторону реакции, по которой вводимое вещество расходуется В сторону реакции, по которой образуется вещество, концентрация которого уменьшается |
| Введение катализатора | Скорость прямой и обратной реакции изменяются одинаково | - |
На смещение химического равновесия может влиять величина рH, определяющая среду, т.е. концентрацию ионов водорода H + в растворе.
Рассмотрим реакции получения хроматов CrO42 - и бихроматов Cr2O7 2 -. Как видно из уравнения
2H + + 2CrO4 2 - ® 2HCrO4- ® Cr2O7 2 - + H2O,
прибавление к раствору кислот (ионов H +) должно смещать равновесие вправо, а прибавление щелочей (ионов OH -) – влево. В соответствии с этим из хроматов легко получить бихроматы и наоборот, например, по реакциям:
K2Cr2O7 + 2KOH ® 2K2CrO4 + H2O,
2K2CrO4 + H2SO4 ® K2Cr2O7 + H2O.
Оборудование и реактивы: пробирки, термостойкие стаканы, водяная баня, хлорид железа (III), бихромат калия, гидроксид калия, серная кислота, водный раствор аммиака, фенолфталеин, крахмал, иод, сосуд с газовой смесью, стакан со льдом, стакан с кипящей водой.
Дата добавления: 2021-09-07; просмотров: 542;











