I тип реакций. Реакции, характерные для органических кислот.
1) Образование солей.
Сульфокислоты относятся к сильным кислотам (по степени диссоциации близки к серной кислоте)
ArSO3H 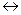 ArSO3- + H+
ArSO3- + H+
Они легко образуют соли, например,
2 C6H5SO3H + Na2CO3  2 C6H5SO3Na + H2O + CO2
2 C6H5SO3Na + H2O + CO2
Na-соли арилсульфокислот хорошо растворимы в воде, и для выделения их в кристаллическом виде прибегают к приему высаливания. Na-соли сульфокислот обладают хорошими моющими свойствами. Их можно использовать в жесткой, даже морской, воде, т.к. кальциевые, магниевые соли сульфокислот растворимы в горячей воде.
2) Образование хлорангидридов сульфокислот.
C6H5SO2OH + PCl5  POCl3 + HCl + C6H5SO2Cl
POCl3 + HCl + C6H5SO2Cl
бензолсульфохлорид
Сульфохлориды – кристаллические вещества, нерастворимые в воде, разлагаются водой только при кипячении. Являются хорошими ацилирующими средствами для спиртов, фенолов, аминов.
3) Образование амидов.
Легче всего протекает при действии аммиака или аминов на сульфохлорид.
С6H5-SO2Cl + NH3  C6H5-SO2-NH2
C6H5-SO2-NH2
-HCl
бензолсульфохлорид бензолсульфамид
или
С6H5-SO2Cl + NH2С6H5  C6H5-SO2-NH-C6H5
C6H5-SO2-NH-C6H5
-HCl
анилин N-фенилбензолсульфамид
Сульфамиды трудно растворимы, хорошо кристаллизуются и используются для идентификации и выделения сульфокислот.
Сульфамиды способны к замещению водородов амидной группы на Сl.
С6H5SO2NH2 + HOCl  HOCl -2H2O
HOCl -2H2O
| 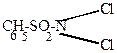
|
| хлорноватистая кислота | хлорамин Б |
Такие вещества обладают хорошими дезинфицирующими и отбеливающими свойствами, т.к. в присутствии воды разлагаются с выделением атомарного кислорода.
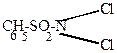
| + HOCl  2HCl + С6H5SO2NH2 + 2O
HOCl 2HCl + С6H5SO2NH2 + 2O
HOCl
|
| бензолсульфамид |
4) образование сложных эфиров.
Чаще всего осуществляется действием сульфохлорида на спирты или фенолы.
С6H5SO2Cl + HOC2H5  HCl + C6H5SO2OC2H5
HCl + C6H5SO2OC2H5
бензолсульфохлорид этанол этиловый эфир бензолсульфокислоты
С6H5SO2Cl + HOC6H5  HCl + C6H5SO2OC6H5
HCl + C6H5SO2OC6H5
бензолсульфохлорид фенол фениловый эфир БСК
Дата добавления: 2020-10-14; просмотров: 1183;











