Односторонние последовательные реакции
Реакции считаются последовательными, если вещество, образующееся в одной реакции, является исходным для другой. Реакции часто встречаются на практике и могут быть моно-, би- или тримолекулярными, односторонними или обратимыми.
Рассмотрим последовательную одностороннюю реакцию первого порядка
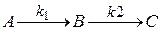
| |||
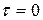
| 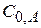
| ||
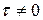
| 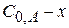
| 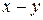
| 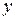
|
В – промежуточное вещество
К любому времени 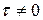
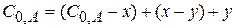
Составим кинетические уравнения для каждой стадии такой реакции
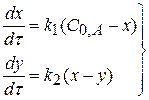 система дифференциалов кинетических уравнений
система дифференциалов кинетических уравнений
Для I стадии реакции:
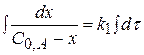 (реакция I порядка)
(реакция I порядка)
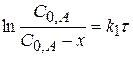 или
или 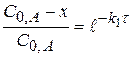 (1.56)
(1.56)
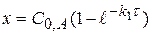 (1.57)
(1.57)
Для второй стадии реакции:
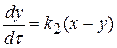 , проведя интегрирование получаем
, проведя интегрирование получаем
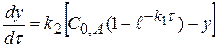 (1.58)
(1.58)
y = 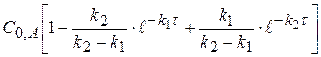 (1.59)
(1.59)
(x-y) = 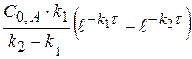 - концентрация промежуточного вещества B ко времени τ.
- концентрация промежуточного вещества B ко времени τ.
Анализ развития последовательной реакции
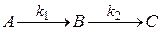
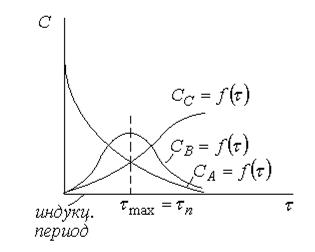
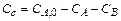
Одной из особенностей последовательных реакций является наличие на графике 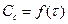 индукционного периода, когда конечный продукт почти не обнаруживается. Кривая в начальный период почти сливается с горизонтальной осью.
индукционного периода, когда конечный продукт почти не обнаруживается. Кривая в начальный период почти сливается с горизонтальной осью.
1) на кривой зависимости 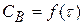 имеется max, соответствующий τmax. Как видно из рисунка в момент max образования промежуточного вещества (B) наблюдается перегиб на кривой зависимости
имеется max, соответствующий τmax. Как видно из рисунка в момент max образования промежуточного вещества (B) наблюдается перегиб на кривой зависимости 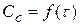 или y = f(τ)
или y = f(τ)
Рассчитаем значение τmax. Когда (x-y) = max, производная равна 0.
(x-y) = 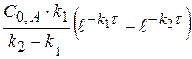
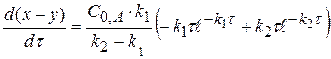
0 = 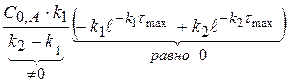
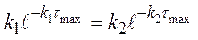
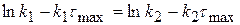
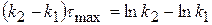
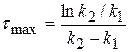 (1.60)
(1.60)
2) Найдем, чему будет равно 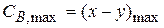 , для этого в уравнение подставим значение τmax:
, для этого в уравнение подставим значение τmax:
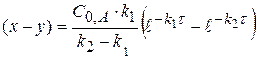 поделим на k1
поделим на k1
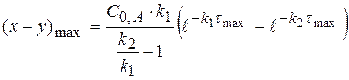
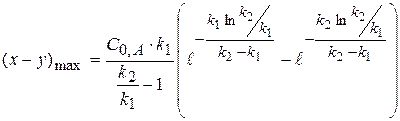 (1.61)
(1.61)
Как видно из уравнения (1.61) max количество промежуточного вещества (B) не зависит от абсолютного значения констант k2 и k1, а определяется только их соотношением. С увеличением соотношения γ = 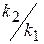
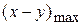 снижается.
снижается.
3) Рассмотрим 2 случая, когда γ1 = 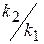 = 2 и γ2 =
= 2 и γ2 = 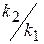 = 10
= 10
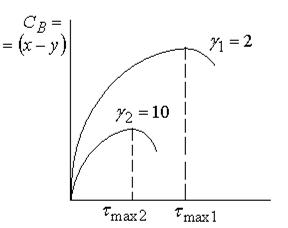
При γ2 = 10, во втором случае, промежуточное вещество будет превращаться значительно быстрее чем возникать (k2 >> k1), его можно не заметить 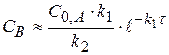 (1.62)
(1.62)
Если k1 >> k2, то скорость возникновения промежуточного продукта выше, чем его расходование. 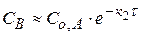 (1.63)
(1.63)
Дата добавления: 2017-03-12; просмотров: 1624;











