IV. Влияние катализатора на скорость реакции
Катализаторы - вещества, изменяющие скорость реакции, но не входящие в состав конечных продуктов. Катализ бывает:
а) положительный - если катализатор увеличивает скорость реакции;
б) отрицательный - если катализатор уменьшает скорость реакции (катализаторы в этом случае называют «ингибиторы»).
Химические реакции, протекающие в присутствии катализатора, называют «каталитические».
Если реагирующие вещества и катализатор находятся в одной фазе, то катализ гомогенный (гомо - однородный), если в различных фазах - гетерогенный (гетеро - разнородный).
Механизм действия катализаторов - образование промежуточных соединений:
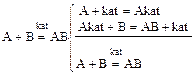
Пример:
Нитрозный способ получения серной кислоты:
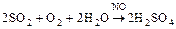
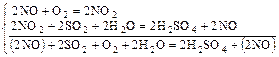
Вещества, снижающие активность твердого катализатора, - каталитические яды (это соединения Hg, Pb, цианиды и др.).
Энергия активации (Еакт) - та избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновения привели к образованию нового вещества. Такие молекулы называют «активные», с ростом температуры их число увеличивается и скорость реакции растёт.
Пример:
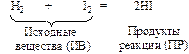
Разрыв старых связей и образование новых схематично можно изобразить:
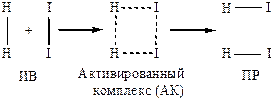
Энергетически продукты реакции(ПР) более выгодны, чем исходные вещества(ИВ):
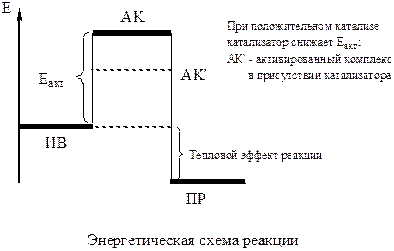
С. Аррениус вывел термодинамическое уравнение зависимости константы скорости. от температуры с учётом энергии активации:
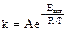 ,
,
где Еакт – константа;
R – универсальная газовая постоянная;
Т – температура, град. К;
А – частотный множитель, доля числа столкновений между молекулами, которая заканчивается реакцией.
Дата добавления: 2017-10-04; просмотров: 2652;











