Гетерогенные химические реакции
Гетерогенными называются процессы, происходящие на границе раздела соприкасающихся фаз. К ним относятся такие процессы как горение топлива, окисление металлов кислородом воздуха, реакции на поверхности катализаторов, кристаллизация чистых жидкостей и т.д.
Скорость гетерогенных процессов зависит от размеров и состояния поверхности раздела фаз, а так же от скорости их относительного движения.
Гетерогенные процессы многостадийны.
Гетерогенные процессы могут протекать на границе между разными фазами:
твердая-твердая, твердая - жидкая, твердая - газообразная, жидкая - жидкая, жидкая - газообразная.
Пусть твердое вещество A(T) реагирует на поверхности с веществом B(P) в растворе с образованием продукта реакции AB(P) в растворе:
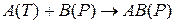
К таким реакциям относится реакция:
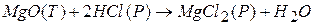
Эта реакция протекает на границе фаз 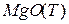 - раствор.
- раствор.
Можно выделить 3 основные стадии процесса:
1) доставка вещества из раствора к поверхности твердого тела;
2) собственно химическая реакция на поверхности твердого тела;
3) отвод продуктов реакции от поверхности вглубь раствора.
Каждая из этих стадий может быть лимитирующей, иметь наименьшую константу скорости и оказывать наибольшее сопротивление процессу.
Если определяющей стадией является химическая (стадия) реакция на границе раздела фаз, то гетерогенный процесс описывается законами химической кинетики и протекает в кинетической области.
Если, как это чаще бывает, медленнее осуществляется подвод и отвод соответствующих веществ, то гетерогенный процесс протекает в диффузионной области и описывается законами диффузии.
Температура сильнее влияет на скорость химической реакции, чем на диффузию. При повышении температуры гетерогенная химическая реакция может перейти из кинетической области в диффузионную (рис. на с. 27).
Доставка вещества к границе между фазами осуществляется за счет конвекции и диффузии. Конвекцией называется перемещение всей среды в целом. Она происходит из-за разности плотности раствора в объеме раствора и вблизи поверхности слоя. Конвекцию создают путем перемешивания твердого тела в растворе или раствора вблизи поверхностного слоя.
Диффузией называется перемещение молекул вещества в неподвижной среде под влиянием градиента концентраций. Количественные закономерности диффузии описываются двумя законами Фика.
Согласно I закону Фика скорость диффузии 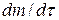 пропорциональна площади поперечного сечения S и градиенту концентрации
пропорциональна площади поперечного сечения S и градиенту концентрации 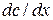 :
:
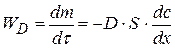 (1.69)
(1.69)
где D – коэффициент диффузии
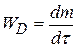 при S = 1м2 и
при S = 1м2 и 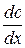 =
= 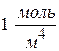
Коэффициент диффузии D возрастает с увеличением температуры, т.к коэффициент вязкости растворителя уменьшается. По уравнению Эйнштейна
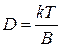 , где B – коэффициент трения (1.70)
, где B – коэффициент трения (1.70)
По закону Стокса для сферических частиц B=6πηr, (1.71)
где η – коэффициент вязкости
r – радиус частиц
тогда уравнение Эйнштейна можно записать:
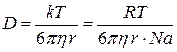 (1.72)
(1.72)
По II закону Фика (устанавливается зависимость изменения концентрации в объеме от времени):
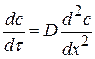 (1.73)
(1.73)
При стационарной диффузии, когда концентрация не зависит от времени, а изменяется только с расстоянием линейно:
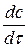 = 0 и
= 0 и 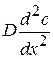 = 0 →
= 0 → 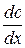 = const =
= const = 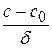 ,
,
где c и c0 – значения концентраций на расстоянии x = δ и x = 0
Исходя из этого, скорость стационарной диффузии будет равна:
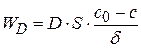 (1.74)
(1.74)
или
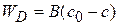 (1.75)
(1.75)
где 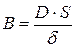 – коэффициент массопереноса; c0 – концентрация в поверхностном слое.
– коэффициент массопереноса; c0 – концентрация в поверхностном слое.
Для гетерогенной реакции, которая имеет I порядок и протекает стационарно, предположим, что скорость химической реакции равна скорости диффузии. Тогда можно записать:
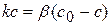 (1.76)
(1.76)
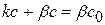
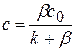 (1.77)
(1.77)
Подставим значение концентрации с в управление скорости реакции I порядка.
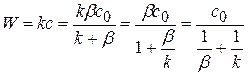 (1.78)
(1.78)
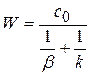 (1.79)
(1.79)
Дроби, стоящие в знаменателе – это диффузионное 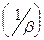 и химическое
и химическое 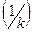 сопротивление.
сопротивление.
Когда 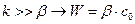 и определяется β , характеризующей диффузию. Процесс протекает в диффузионной области.
и определяется β , характеризующей диффузию. Процесс протекает в диффузионной области.
 Если
Если 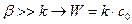 - суммарный процесс определяется химической стадией и протекает в кинетической области.
- суммарный процесс определяется химической стадией и протекает в кинетической области.
Зависимость - влияние температуры на константу скорости гетерогенной реакции
γ – температурный коэффициент
Вывод интегрального кинетического уравнения для расчета константы гетерогенной реакции
Если гетерогенная химическая реакция протекает в кинетической области, то 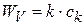 ,если считать, что эта реакция первого порядка (nk = 1).
,если считать, что эта реакция первого порядка (nk = 1).
При протекании гетерогенной реакции в диффузионной области можно записать, что
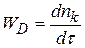 ;
; 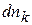 ~ dmk (1.80)
~ dmk (1.80)
Согласно первому закону Фика скорость диффузии или изменение числа молей компонента во времени будет рассчитываться по уравнению:
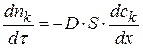
Поделим обе части уравнения на объем реакционной системы – V, тогда:
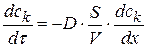 (1.81)
(1.81)
При условии 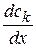 =1
=1 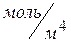 ,
, 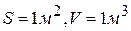 удельная скорость диффузии
удельная скорость диффузии 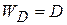 равна коэффициенту диффузии. При произвольных значениях площади поверхности раздела фаз и объема реакционной смеси
равна коэффициенту диффузии. При произвольных значениях площади поверхности раздела фаз и объема реакционной смеси
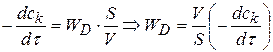 (1.82)
(1.82)
С учетом стехиометрического коэффициента k - компонента уравнения примет следующий вид:
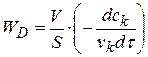 (1.83)
(1.83)
В стационарных условиях при равновесии 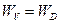
k 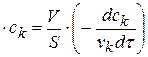
разделим переменные и проинтегрируем:
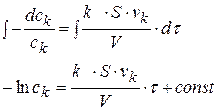
при 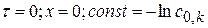
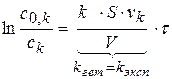
k определяется, исходя из экспериментального значения константы - kэксп
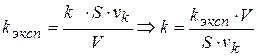 (1.84)
(1.84)
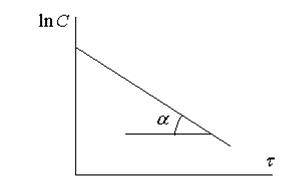
Определение kэксп проводят графическим путем, построив график в координатах 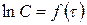 .
.
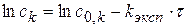
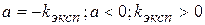
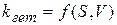 и определяется соотношением площади поверхности раздела фаз и объема реакционной смеси.
и определяется соотношением площади поверхности раздела фаз и объема реакционной смеси.
Дата добавления: 2017-03-12; просмотров: 2528;











