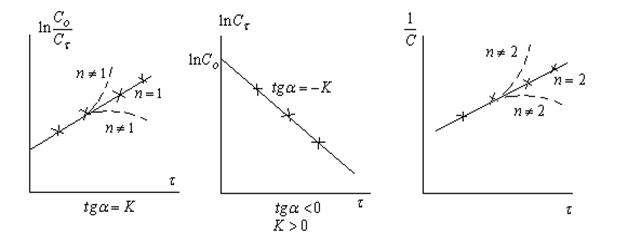
Методы определения порядка реакции
Порядок реакции является эмпирической величиной и не может быть рассчитан теоретически, если не известен механизм реакции. Для его определения разработаны различные методы
1) Метод подстановки. Заключается в том, что экспериментальные данные зависимости с 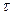 =f(
=f( 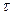 ) подставляют в кинетические уравнения разных порядков и находят какое из них дает постоянное значение константы скорости реакции.
) подставляют в кинетические уравнения разных порядков и находят какое из них дает постоянное значение константы скорости реакции.
2) Графический метод. Зависимость концентрации от времени для реакции различного порядка может быть выражена прямой линией, если выбрать соответствующую систему координат.
Для реакций I порядка прямая получается в системе координат ln c = f( 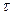 ),
),
II порядка (1/с)= f( 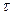 ),
),
III порядка (1/с2 )= f( 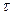 ).
).
а) Дифференциальной метод
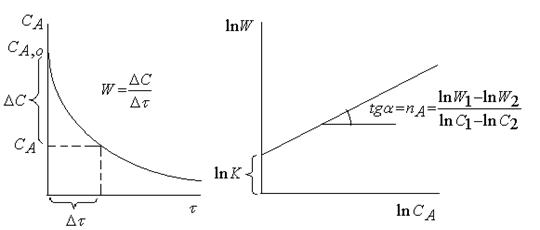
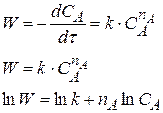
Для концентрации 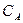 по кинетической кривой определяют
по кинетической кривой определяют 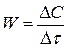
б) Интегральный метод
3) Метод определения по Раковскому (по периоду полупревращения)
Для реакций I порядка 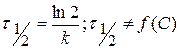
II порядка 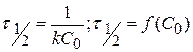
III порядка 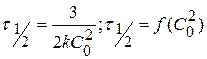
Для определения n берутся различные начальные концентрации веществ, определяют время полупревращения, определяют зависимость и делают вывод о n.
Из уравнения (1.42) для реакций nго порядка
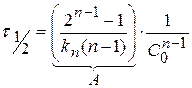
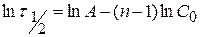
Для определения n строится график
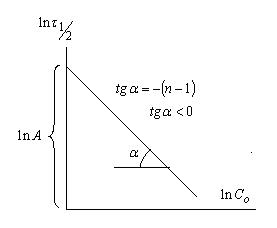
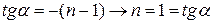
Порядок реакции может быть 1,2,3, а также дробным. Если n = 0, то график пойдет параллельно оси абсцисс.
Определив n и зная ln А можно рассчитать значения k
4) Метод изолирования Оствальда
Для реакции 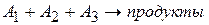
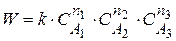
Пусть нужно найти n1 – частный порядок реакции по 1 компоненту. Задаем условия
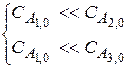
Тогда скорость реакции 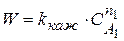
Концентрации компонентов А2 и А3 оставляем постоянными, варьируем только СА1,0 , находим n1.
Далее оставляем постоянными СА1,0 и СА3,0 и варьируем СА2,0 → n2 и т.д.
Дата добавления: 2017-03-12; просмотров: 2604;











