Зависимость скорости химической реакции от температуры.
Уравнение Аррениуса.
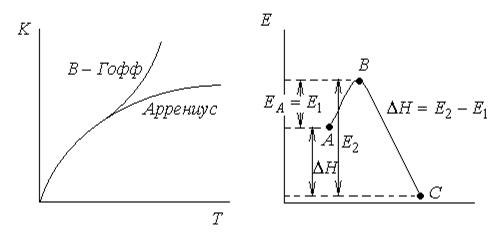
Скорость химической реакции зависит не только от концентрации реагентов, но и от температуры. По правилу Вант-Гоффа увеличение температуры на 10о приводит к увеличению скорости реакции в 2-4 раза.
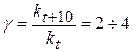 - температурный коэффициент скорости химической реакции
- температурный коэффициент скорости химической реакции
Более строгая зависимость k от T выражается уравнением Аррениуса:
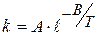 (1.64)
(1.64)
где A и B – const; A – предэкспоненциальный множитель, B= 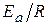 ;
;
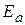 - энергия активации химической реакции
- энергия активации химической реакции
Другая запись уравнения Аррениуса:
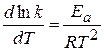 (1.65)
(1.65)
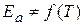 , а зависит от природы реакции. Пользуясь этим уравнением можно определить энергию активации, если известны k при различных температурах.
, а зависит от природы реакции. Пользуясь этим уравнением можно определить энергию активации, если известны k при различных температурах.
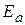 обычно > 0 и равна 50-500 Дж/моль,
обычно > 0 и равна 50-500 Дж/моль, 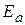 < 0 реже.
< 0 реже.
Для газофазных реакций A = 1012 -1016C-1
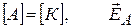 - величина потенциального барьера.
- величина потенциального барьера.
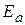 находят часто графическим решением уравнения Аррениуса:
находят часто графическим решением уравнения Аррениуса:
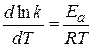
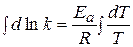
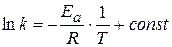
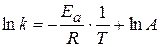 (1.66)
(1.66)
Строят график в координатах
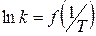
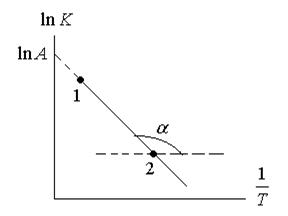
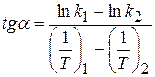 (1.67)
(1.67)
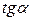 < 0;
< 0; 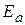 = -R
= -R 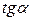 ;
; 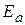 > 0
> 0
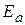 можно рассчитать аналитически, зная значение константы скорости реакции при двух различных температурах.
можно рассчитать аналитически, зная значение константы скорости реакции при двух различных температурах.
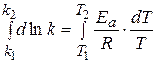
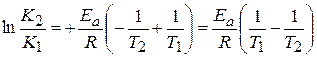
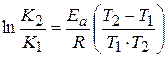
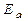 =
= 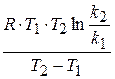 (1.68)
(1.68)
Дата добавления: 2017-03-12; просмотров: 1830;











