I. Реакции фенольного гидроксила
1. Кислотные свойства.Фенолы - слабые кислоты, они слабее, чем угольная и карбоновые кислоты, со щелочами дают феноляты и воду: 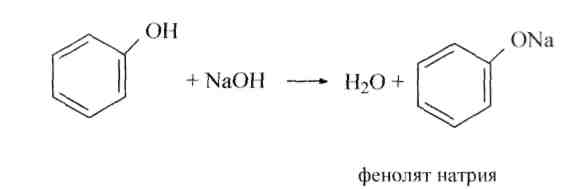
но из растворов фенолятов фенолы вытесняются углекислым газом:

Приведенными реакциями пользуются при выделении фенолов из смеси с другими соединениями.
Фенолы, как и спирты, не изменяют окраски индикаторов, но кислотные свойства у них выражены хотя и слабо, но сильнее чем у воды и спиртов: С6Н5ОН > Н20 > С2Н5ОН. У фенолов р-электроны кислорода входят в сопряжении с π-электронами ядра (энергия ~2 ккал/моль), увеличивая электронную плотность в орто- и пара-положениях. Это приводит к активации ядра в электрофильных реакциях замещения и к поляризации связи О←Н.
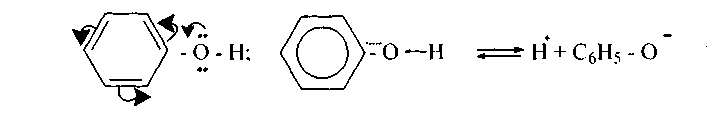
Кислотные свойства фенола усиливаются, если имеются электроноакцепторные группы, связанные с ядром, такие, как -N02, -SO3H и др.
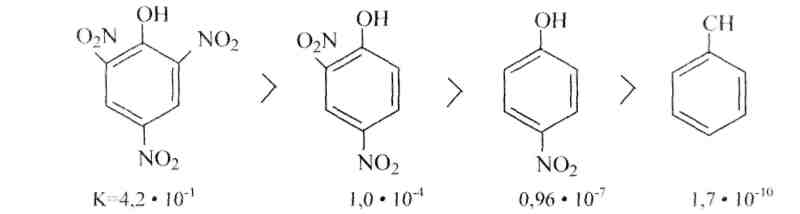
Например, в этом ряду пикриновая кислота (2,4,6-тринитрофенол) является самой сильной, по константе диссоциации приближается к минеральным кислотам.
89. Напишите уравнения реакций и назовите продукты.
а) м-крезол + едкий калий; б) п-крезолят натрия + углекислота; в) тимол + едкий натр; г) пикриновая кислота + поташ; д) фенолят калия + углекислота; е) 2,4-динитрофенол + сода: ж) тимолят натрия + углекислота; з) п-крезол + едкий натр.
Качественная реакция на фенолы.Для открытия фенолов и енолов (енольных форм некоторых альдегидов и кетонов) используют цветную реакцию с водным раствором хлорного железа. Обычно появление окрашивания от синего до фиолетового указывает на присутствие фенолов, от кроваво-красного до василькового - алифатических енолов. В отличие от енолов фенолы лучше дают реакцию в присутствии воды:
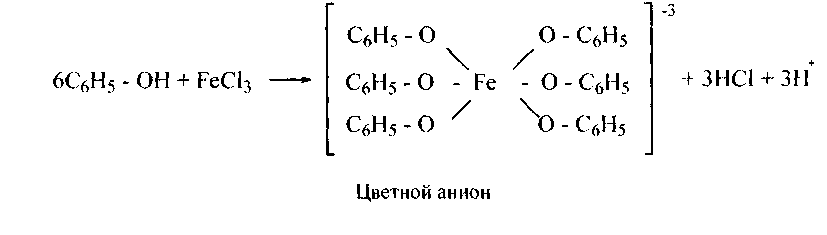
90. Для фенолов, приведенных в упражнении 87, напишите уравнения цветной реакции с хлорным железом.
2. Реакция образования простых и сложных эфиров. Фенолы в отличие от спиртов труднее образуют простые и сложные эфиры. Простые эфиры фенолов получаются при действии на феноляты галогенпроизводных, в присутствии медного порошка:
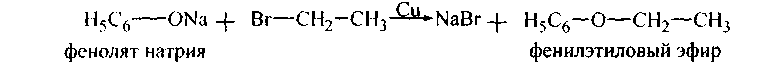
Фенолы непосредственно карбоновыми кислотами не этерифицируются. Сложные эфиры фенолов и карбоновых кислот могут быть приготовлены действием ангидридов или галогенангидридов кислот на феноляты или на растворы фенолов в пиридине.
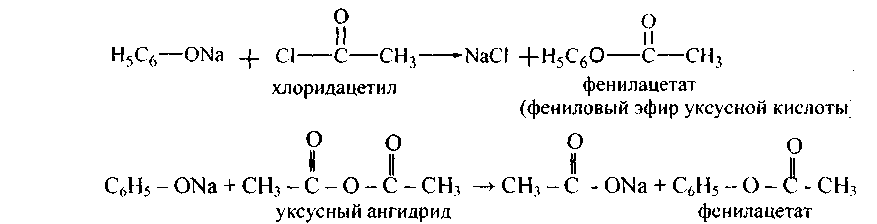
91.Напишите уравнения реакций и назовите продукты.
а) фенолят калия + метилбромид;
б) фенолят натрия + изопропилхлорид;
в) о-крезолят натрия + трет-бутилхлорид;
г) м-крезолят калия + уксусный ангидрид;
д) фенол (в пиридине) +уксусный ангидрид;
е) п-крезолят натрия + ацетилхлорид;
ж) п-крезол (в пиридине) + уксусный ангидрид;
з) п-крезолят натрия + уксусный ангидрид;
и) п-крезолят натрия + метилйодид;
к) м-крезолят натрия + метилбромид.
3. Реакция замещения гидроксила на галоген у фенолов идет труднее, чем у спиртов, ибо связь С-ОН у фенолов более прочная. Галогеноводороды на фенолы не действуют, a PCl5 с небольшим выходом образует хлорбензол. Процесс осложняется побочными реакциями.
4. Восстановление фенолов в арены происходит при перегонке фенолов с цинковой пылью;
С6Н5 - ОН + Zn → С6Н5 + ZnO
92. Для фенолов, приведенных в упражнении 87, напишите уравнения реакций восстановления цинковой пылью. Назовите продукты реакции.
Дата добавления: 2017-05-02; просмотров: 5657;











