Реакции электрофильного замещения
Большая доступность (по энергии) ВЗМО пятичленных гетероароматических соединений по сравнению с бензолом является причиной их повышенной реакционной способности, прежде всего в реакциях электрофильного ароматического замещения. Например, пиррол способен к реакциям замещения даже с такими слабыми электрофилами, как ионы арендиазония.
 |  |
 + C6H5N+ ≡ NCl– + HCl
+ C6H5N+ ≡ NCl– + HCl

 N N N = NC6H5
N N N = NC6H5
H H
пиррол бензолдиазоний хлорид 2 – (фенилазо)пиррол
Относительная активность пятичленных гетероаренов в реакциях SE Ar снижается в ряду:
пиррол > фуран > тиофен
Так, относительная скорость реакции ацетилирования трифторуксусным ангидридом соответственно растет: тиофен – 1, фуран – 140, пиррол – 5,3 · 107.
Но даже тиофен значительно превосходит бензол по реакционной способности. Факторы парциальных скоростей для реакции электрофильного замещения в тиофене в присутствии трифторуксусной кислоты выглядят следующим образом:




 1,9·104
1,9·104

 3,2·107
3,2·107
S
Атака электрофилом гетероцикла облегчается и идет в первую очередь в α-положение кольца, то есть по сравнению с бензолом кольцо гетероцикла более нуклеофильное, в котором гетероатом играет роль заместителя 1-го рода. Если α-положение кольца занято, то атакуется β-положение кольца. Такое направление реакции определяется большей стабильностью σ-комплексов при α-замещении, чем при β-замещении:

 Н Н
Н Н














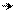














 Э Э
Э Э
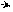

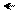





 ••
•• 
 Н + Н •• +
Н + Н •• +
Х Э Х Э Х Х
σ –комплекс при α-замещении σ –комплекс при β -замещении
(в сопряжении участвует двойная связь) (сопряжение меньше, в нем не участвует двойная связь)
Согласно концепции граничных орбиталей, предпочтительность электрофильной атаки положений 2 и 5 пятичленных гетероаренов определяется большими значениями собственных коэффициентов ВЗМО именно в этих положениях.





 –0,37 0,37
–0,37 0,37
 + Э+ продукт
+ Э+ продукт

 –0,60 0,60
–0,60 0,60
Х
гетероарен электрофил
(донор) (акцептор)
В связи с повышенной чувствительностью пятичленных гетероароматических соединений к сильным кислотам в ряде их реакций электрофильного замещения применяют модифицированные электрофильные реагенты. При использовании этих реагентов исключается сильнокислая среда.
Например,


 О
О
 СН3 – С + (CH3CO)2O
СН3 – С + (CH3CO)2O
ONO2
ацетилнитрат уксусный ангидрид нитрующие агенты
HNO3 + CH3COOH

 N+–SO3– сульфирующий агент
N+–SO3– сульфирующий агент
пиридинсульфотриоксид
(CH3CO)2O + кислота Льюиса ацетилирующий агент
(BF3, SnCl4, ZnCl2)
С использованием этих реагентов реакции с пятичленными гетероароматическими соединениями идут в мягких условиях и с хорошим выходом.
Реакции электрофильного замещения идут с высокой региоселективностью и преимущественно в положение 2 (5) цикла.
А) Галогенирование
Реакция галогенирования идет в мягких условиях, например, хлорирование идет в присутствии хлористого сульфурила сначала в положения α, α΄, а затем в β-положение:
 Cl
Cl






























 SO2Cl2 SO2Cl2 SO2Cl2
SO2Cl2 SO2Cl2 SO2Cl2
 •• –HCl, –SO2 •• –HCl, –SO2 •• –HCl, –SO2 ••
•• –HCl, –SO2 •• –HCl, –SO2 •• –HCl, –SO2 ••

 О O Cl Cl O Cl Cl O Cl
О O Cl Cl O Cl Cl O Cl
•• •• •• ••
фуран 2-хлорфуран 2,5-дихлорфуран 2,3,5-трихлорфуран
(α-хлорфуран) (α, α΄-дихлорфуран) (α, α΄, β-трихлорфуран)
Другой пример, бромирование тиофена:













 CH3COOH
CH3COOH


 •• + 2Br2 •• + 2 HBr
•• + 2Br2 •• + 2 HBr
S Br S Br
•• ••
тиофен 2,5-дибромтиофен
Б) Нитрование
Нитрование происходит в мягких условиях. Азотная кислота применяется только для тиофена, а фуран нитруется ацетилнитратом в пиридине:













 HNO3 (H2SO4)
HNO3 (H2SO4)


 •• •• + H2O
•• •• + H2O
 S S NO2
S S NO2
•• ••
тиофен 2-нитротиофен






 CH3COONO2
CH3COONO2
 •• + CH3COOH
•• + CH3COOH
(CH3CO)2O, 100C S NO2
••
2-нитротиофен
(α-нитротиофен)













 C5H5N
C5H5N

 •• + СH3COONO2 •• + CH3COOH
•• + СH3COONO2 •• + CH3COOH
О O NO2
•• ••
фуран 2-нитрофуран
(α-нитрофуран)






 (CH3CO)2O, 50C
(CH3CO)2O, 50C







 + CH3COONO2 + CH3COOH
+ CH3COONO2 + CH3COOH
 •• ••
•• ••

 N N NO2
N N NO2
H H
пиррол 2-нитропиррол
(α-нитропиррол)
В) Сульфирование
Сульфирование происходит легче бензола. Тиофен сульфируется концентрированной серной кислотой, а фуран и пиррол – комплексом триоксида серы в пиридине:













 00С
00С

 •• + H2SO4 (конц.) •• + H2O
•• + H2SO4 (конц.) •• + H2O
S S SO3H
•• ••
тиофен тиофен-2-сульфокислота
 | |||||||||
 |  |  |  | ||||||


 •• + С5H5N – SO3 •• +
•• + С5H5N – SO3 •• +
О O SO3H N
•• ••
фуран фуран–2–сульфокислота пиридин
(фуран- α-сульфокислота)
 |  |  |  |

 •• + С5H5N – SO3 •• + C5H5N
•• + С5H5N – SO3 •• + C5H5N

 N N SO3H
N N SO3H
HH
пиррол пиррол-2-сульфокислота
Г) Ацилирование
Ацилирование проходит в мягких условиях, часто ацилирующими агентами служат ангидриды карбоновых кислот в присутствии кислот Льюиса (реакции изучены Терентьевым).













 BF3
BF3



 •• + (CH3CO)2O •• O + CH3COOH
•• + (CH3CO)2O •• O + CH3COOH
 O O C
O O C
•• •• CH3
фуран 2-ацетилфуран
(α-ацетилфуран)
(CH3CO)2O, 200C
 | |||||
 |  | ||||


 •• O + CH3COOH
•• O + CH3COOH


 •• N C
•• N C
 N H CH3
N H CH3
H 2-ацетилпиррол
(α-ацетилпиррол)






 CHCl3, 3KOH
CHCl3, 3KOH


 •• O + 3 KCl + 2 H2O
•• O + 3 KCl + 2 H2O

 N C
N C
H H
2-формилпиррол
(α-формилпиррол)
Сравнение реакционной способности в реакциях SE2 пиррола, фурана, тиофена, бензола, нафталина
В ряду пиррол, фуран, тиофен, бензол и нафталин по реакционной способности в реакциях SE2 на первом месте находится пиррол.
У пиррола нет полной делокализации π-электронов, так как не существует 10-электронного атома азота:


















 –0,06
–0,06


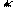

 •• •• –0,1
•• •• –0,1



 N N N +0,31
N N N +0,31
H H H
8-электронный атом азота 10-электронный атом азота распределение зарядов в пирроле
У фурана атом кислорода более электроотрицателен, чем атом азота, и делокализации π-электронов еще меньше, чем в молекуле пиррола. Поэтому дипольный момент у фурана 0,7 D, а у пиррола 1,8 D. Отсюда фуран менее ароматичен, чем пиррол (Есопряжения фурана = 96,6 кДж/моль, Есопряжения пиррола = 130 кДж/моль). У фурана больше свойств диена.
Тиофен наиболее ароматичен по сравнению с пирролом и фураном, так как атом серы может быть 4-х валентным и 10-электронным благодаря переходу 3р-электрона на высшую 3d- или 4s-орбитали.
 |  |

























 Атом S, n = 3 B=2 B=4
Атом S, n = 3 B=2 B=4

 s px py pz s p d
s px py pz s p d
Поэтому у тиофена делокализация π-электронов происходит всех больше:
 | |||
 | |||


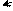
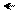
 ••
••
 S S
S S
•• ••
Отсюда, по ароматичности на первом месте находится тиофен, на втором – пиррол, на третьем – фуран.
По реакционной способности в реакциях замещения электрофильного характера на первом месте находится пиррол, на втором – фуран, на третьем – тиофен.
То есть пятичленные гетероциклы более реакционноспособные, чем бензол, в реакциях SE2.
Сравнивая бензол и нафталин в реакциях SE2, безусловно, нафталин является более реакционноспособным по сравнению с бензолом из-за наличия в нафталине 10-π-электронной ароматической связи (по правилу Хюккеля 4n+2, при n=2). К тому же выравненность связей в нафталине нарушена (см. тему «Нафталин»).
Поэтому в указанном ряду по реакционной способности в реакциях SE2 соединения будут расположены следующим образом:
пиррол > фуран > тиофен > нафталин > бензол
Дата добавления: 2017-01-16; просмотров: 3219;











