Физические свойства и строение
Свежеперегнанный пиррол – бесцветная жидкость, т.кип. 1300С с характерным запахом; на воздухе и на свету быстро окрашивается в красно-коричневый цвет, со временем – осмоляется.
Фуран представляет собой бесцветную жидкость, т.кип. 310С; имеет слабый запах хлороформа; в воде не растворяется, но смешивается со всеми органическими растворителями.
Тиофен – бесцветная жидкость, т. кип. 84,10С; обладает слабым запахом; не растворяется в воде, смешивается с органическими растворителями.
Молекулы всех пятичленных гетероароматических соединений имеют плоское строение. Ароматический секстет π-электронов в этих молекулах образуется за счет π-электронов атомов углерода и неподеленных электронов гетероатомов, находящихся на негибридизованных рz-орбиталях.
 |  |  |



























 • • • • • •
• • • • • •





 • •• • •• • ••
• •• • •• • ••



 •N H • O •••S ••
•N H • O •••S ••



пиррол фуран тиофен







Х (Х = N, O, S)
расположение π-электронного облака
Каждый из атомов углерода и гетероатомов в этих соединениях находится в состоянии sp2- гибридизации и имеет по одной негибридизованной 2 рz- орбитали, ориентированной перпендикулярно плоскости цикла. Эти орбитали эффективно перекрываются и формируют ароматические секстеты π-электронов в молекулах.
Теория резонанса подтверждает ароматический характер фурана, пиррола и тиофена. Набор пяти резонансных структур, приведенных ниже, описывает делокализацию π-электронов в основном состоянии пиррола:






























 – –
– –





 •• – + + – + +
•• – + + – + +


 N N N N N
N N N N N
H H H H H
В результате сопряжения кольцо становится плоским, простые связи укорачиваются.



 0,143нм
0,143нм
107,50 0,137нм

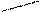

 1280
1280
108,90 0,138нм
NH
молекулярная диаграмма пиррола
Образование ароматического секстета, вовлекающего свободную пару электронов гетероатама, имеет с одной стороны сумму ароматических свойств гетероцикла, с другой стороны потерю нуклеофильных свойств гетероатомом (например, азот пиррола лишен основных свойств). Отсюда, гетероатом как бы обезличивается.
Ароматическое состояние π-электронов в указанных соединениях подтверждается и расчетом в рамках теории МО.
Например, в молекуле фурана шесть π-электронов находятся на трех связывающих молекулярных π-орбиталях, имеющих значения собственных энергий ниже уровня энергии α.


 Энергия МО
Энергия МО
 | |||
 | |||


 α +1,62β φ5 φ5
α +1,62β φ5 φ5










 α – 0,94β φ4 НСМО
α – 0,94β φ4 НСМО

φ4 (НСМО)


 α
α












 α +0,62β φ3 ВЗМО φ3 (ВЗМО)
α +0,62β φ3 ВЗМО φ3 (ВЗМО)
 | |||
 | |||
 α +1,31β
α +1,31β 


 φ2 φ2
φ2 φ2













 4 3
4 3





 α +2,63β φ1 φ1 5 2
α +2,63β φ1 φ1 5 2

 О1
О1
Энергетическая диаграмма молекулярных π-орбиталей фурана
Из расчета следует, что энергия ВЗМО фурана, равная (α +0,62β) заметно выше, чем энергия ВЗМО бензола, равная (α +β). То же справедливо для пиррола и тиофена. Этот факт соответствует тому обстоятельству, что все три гетероатома относятся к числу электроноизбыточных гетероциклов: шесть π-электронов в их молекулах делокализованы между пятью атомами цикла.
Более высокие электронодонорные свойства пятичленных гетероароматических соединений обнаружены и экспериментально. Ниже приведены значения первых потенциалов ионизации и электронного сродства фурана, пиррола, тиофена в сравнении с данными для бензола.
Интересно, что фуран, пиррол и тиофен имеют практически одинаковые значения первых потенциалов ионизации. Причина этого заключается в том, что гетероатомы не участвуют в формировании ВЗМО пятичленного гетероароматического соединения (имеют нулевое значение собственного коэффициента, как видно из показанной выше диаграммы. В то же время перечисленные соединения заметно различаются значениями электронного сродства.
Дата добавления: 2017-01-16; просмотров: 1770;











