ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Одним из вариантов классификации химических реакций может быть подразделение их на две большие группы.
1.Реакции, в которых взаимодействие электронных оболочек у реагирующих частиц сводится к образованию общих молекулярных орбиталей с соответствующим количеством ковалентных связей.
2.Реакции, в которых столкновение частиц сопровождается переходом электронов от одного из реагентов к другому. Эти реакции получили название ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫЕ. В отечественной литературе часто используется сокращение ОВР, а в иностранной REDOX от латинских восстановление-окисление.
Частица, отдающая свои электроны, называется ВОССТАНОВИТЕЛЬ (обозначим ее как ВОС), а частица, которая эти электроны присоединяет, – ОКИСЛИТЕЛЬ (обозначим ОК).
Окислительно-восстановительные реакции очень широко распространены в природе. К ним относятся реакции фотосинтеза у растений, дыхание живых организмов, процессы горения и коррозии металлов и многие другие.
СТЕПЕНЬ ОКИСЛЕНИЯ
Для характеристики окислительно-восстановительной способности частиц очень важное значение имеет такое понятие, как степень окисления. Эта величина служит для характеристики состояния атома в молекуле или ионе. СТЕПЕНЬ ОКИСЛЕНИЯ – это заряд, который мог бы возникнуть у атома в молекуле или ионе, если бы все его связи с другими атомами оказались разорваны, а общие электронные пары ушли с более электроотрицательными элементами.
В отличие от реально существующих зарядов у ионов, степень окисления показывает лишь возможный заряд атома в молекуле. Она может быть отрицательной, положительной и нулевой. Например, степень окисления атомов в простых веществах равна «0» ( Н20, Cu0, S0, N20). В химических соединениях атомы могут иметь постоянную степень окисления или переменную. У металлов I, II и III групп (главные подгруппы) в химических соединениях степень окисления постоянна и равна соответственно Ме+1, Ме+2 и Ме+3 (Li+, Ca+2, Al+3). У атома фтора всегда -1. У хлора в соединениях с металлами всегда -1. В подавляющем числе соединений кислород имеет степень окисления -2 (кроме пероксидов, где его степень окисления -1), а водород +1(кроме гидридов металлов, где его степень окисления -1).
Алгебраическая сумма степеней окисления всех атомов в нейтральной молекуле равна нулю, а в ионе – заряду иона. Эта взаимосвязь позволяет рассчитывать степени окисления атомов в сложных соединениях.
В молекуле серной кислоты H2SO4 атом водорода имеет степень окисления +1, а атом кислорода -2. Так как атомов водорода два, а атомов кислорода четыре, то мы имеем два «+» и восемь «-». До нейтральности не хватает шесть «+». Именно это число и является степенью окисления серы - H2+1S+6O4-2. Молекула дихромата калия K2Cr2O7 состоит из двух атомов калия, двух атомов хрома и семи атомов
кислорода. У калия степень окисления всегда +1, у кислорода -2. Значит, мы имеем два «+» и четырнадцать «-». Оставшиеся двенадцать «+» приходятся на два атома хрома, у каждого из которых степень окисления равна +6 (K2+1 Cr2+6 O7-2). Окислительно-восстановительная реакция является сопряженной и условно может быть разбита на две полуреакции – процесс окисления и процесс восстановления, хотя на самом деле передача электронов от восстановителя к окислителю происходит одновременно. В химии условный заряд электрона принят за «-1» и обозначается  Схемы полуреакций окисления и восстановления можно представить следующим образом:
Схемы полуреакций окисления и восстановления можно представить следующим образом:
ВОС - n  = ВОС+n – окисление восстановителя
= ВОС+n – окисление восстановителя
ОК +  = ОК-n – восстановление окислителя
= ОК-n – восстановление окислителя
ВОС + ОК = ВОС+n + ОК-n – суммарная окислительно-восстановительная реакция, в которой отданные и принятые электроны при сложении сократились.
Очевидно, что число отданных и принятых электронов должно быть одинаковым. Если восстановитель отдает два электрона, а окислитель может принять только один, то число участвующих в реакции частиц окислителя должно быть удвоено.
ВОС - 2  = ВОС+2 – окисление восстановителя
= ВОС+2 – окисление восстановителя
2 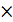 ОК +
ОК +  = ОК- – восстановление окислителя
= ОК- – восстановление окислителя
ВОС + 2ОК = ВОС+2 + 2ОК- - суммарная окислительно-восстановительная реакция. Именно такая общая схема заложена в методах подбора стехиометрических коэффициентов в окислительно-восстановительных реакциях.
Дата добавления: 2021-01-26; просмотров: 454;











