Цвета кислотно-основных индикаторов в зависимости от рН раствора
| Индикатор | Шкала рН 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 | ||||||
| Метиловый оранжевый | красный | 3,0-4,4 | Желто-оранжевый | ||||
| Лакмус | красный | 5,0-8,0 | синий | ||||
| Фенолфталеин | бесцветный | 8,1-9,8 | Малиново-красный | ||||
Использование индикаторов позволяет только приблизительно оценить рН раствора.
Для точного измерения кислотности среды используются приборы, называемые рН-метры. Точность измерения рН составляет 0,01 единицы в диапазоне от -1 до 15. В аналитической химии наиболее точно концентрацию ионов водорода в растворе определяют методом кислотно-основного титрования.
4. РАВНОВЕСИЕ В РАСТВОРАХ ТРУДНО РАСТВОРИМЫХ ВЕЩЕСТВ.
Рассмотрим систему, состоящую из кристаллов малорастворимого вещества и его ионов в насыщенном растворе. Так как растворимость вещества очень мала, то иего концентрация в растворе также очень мала и, значит, степень диссоциации для них будет приближаться к единице. При установившемся равновесии в единицу времени в раствор будет переходить столько же ионов, сколько их будет
выпадать в осадок.
Процесс растворения можно представить следующим образом
КАкр = К+р + А-р .
Обратная реакция является процессом кристаллизации вещества.
Для такой системы константа равновесия будет равна
Kд = 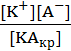 .
.
Так как концентрация вещества в твердой фазе [KAкр] величина постоянная, то ее можно объединить с константой диссоциации и получить новую константу.
Константа равновесия в системе осадок/насыщенный раствор носит название ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ (ПР).
ПР = [К+][А-] (7.16)
Если при диссоциации соли образуется более двух ионов, то концентрации ионов в уравнении берут в степенях, соответствующих их стехиометрическим коэффициентам.
КnAm = nK+m + mA+n , (7.17)
ПР = [K+m]n [A+n]m . (7.18)
Произведение растворимости является табличной величиной и зависит только от природы растворенного вещества и температуры.
Чем меньше величина ПР, тем меньше ионов переходит в раствор и тем меньше растворимость вещества.
Зная величину ПР, можно рассчитать растворимость вещества, т.е. его концентрацию в насыщенном растворе (S,моль/л)
S =  , (7.19)
, (7.19)
Где n и m стехиометрические коэффициенты в уравнении (7.17).
До тех пор, пока произведение концентраций ионов в растворе не превысит величину ПР данной соли, вещество в осадок выпадать не будет.
Соотношение (7.19) справедливо лишь для случая, когда в растворе существует только одно растворенное вещество.
Если там растворить дополнительно еще один электролит, содержащий хотя бы один одноименный ион, то равновесие сдвинется в сторону процесса кристаллизации (влево), что приведет к уменьшению концентрации раствора и позволит более полно выделить растворенное вещество из жидкой фазы в твердую.
4. РЕАКЦИИ ИОННОГО ОБМЕНА.
Реакции обмена между ионами в растворе протекают без изменения их зарядов и имеют обычно большую скорость. Рассмотрим четыре типичных варианта таких реакций.
Реакции, идущие с образованием осадков. При смешении растворов хлорида бария и сульфата натрия, которые относятся к классу хорошо растворимых веществ, образуется кристаллический осадок сульфата бария. Молекулярное уравнение (МУ) этой реакции
ВаС12(р) + Na2S04(р) = ВаS04(кр)↓ + 2NaCl(р)
Все представленные вещества являются сильными электролитами и в растворе в виде молекул существовать не могут. Запишем реакцию в виде ионно-молекулярного уравнения (ИМУ):
Ва2+ + 2Cl- + 2Na+ + SO42- = ВаS04(кр)↓+ 2Na+ + 2Cl-
Сущность этого процесса выражает ионное уравнение
Ва2+(р) + SO42-(р) = Ва2S04(кр)¯
Так как BaS04 выпадает в осадок, который не участвует в обратной реакции растворения, то и равновесие данного процесса практически нацело смещено вправо и реакция идет до конца в открытой системе.
Реакции, идущие с образованием газов. Взаимодействие концентрированных растворов хлорида натрия и серной кислоты приводит к образованию газообразного хлористого водорода:
(МУ) NaCI(р) + H2S04(р) = HCl(г) + NaHS04(р)
(ИМУ) Na+ + Cl- + 2Н+ + SO42- = HCl(г) + Na+ + HSO4-
Н+(р) + Cl-(р) =HCl(г)
Равновесие данной реакции практически нацело смещено вправо, так как одним из продуктов реакции является летучее вещество, покидающее зону реакции (раствор).
Реакции, идущие с образованием слабых электролитов. Причиной данных реакций является образование очень устойчивых молекул. Добавив к раствору цианида калия раствор соляной кислоты, мы получим цианистоводородную кислоту, которая является слабым электролитом и в растворе присутствует в основном в виде молекул.
(МУ) KCN(p) + HCl(p) = HCN(p) + KCl(p)
(ИМУ) K+ + CN- + Н+ + Cl- = HCN + K+ + Cl-
CN-(p) + Н+(p) = HCN(p) Кд HCN = 8∙10-10
Образование слабодиссоциирующих молекул HCN сдвигает равновесие вправо. Обобщая этот пример, можно сделать вывод о том, что сильные кислоты и основания «вытесняют» из растворов более слабые.
К этому же типу реакций относятся реакции нейтрализации между кислотами и основаниями, в результате которых образуется слабый электролит – вода.
Реакции, идущие с образованием комплексных ионов. Комплексные ионы относятся к разряду слабых электролитов, поэтому равновесие сильно смещено вправо.
Zn2+(p) + 4NH3(p) = [Zn(NHЗ)4]2+(p)
Подводя итог сказанному, можно сделать вывод: если в результате обменной реакции могут образоваться труднорастворимые вещества, газы, слабодиссоциирующие вещества (слабые электролиты или комплексные ионы), то эти реакции идут практически необратимо в прямом направлении.
5. ГИДРОЛИЗ
Гидролиз – это реакции обменного взаимодействия между частицами растворенного вещества и молекулами воды. Гидролизу подвергаются вещества разных классов (соли, углеводы, белки, жиры, эфиры и другие соединения). В результате гидролиза солей образуются слабые электролиты - кислоты и основания. Это происходит за счет смещения равновесия процесса электролитической диссоциации воды.
Гидролиз является результатом поляризационного взаимодействия ионов соли с их гидратными оболочками. Чем оно сильнее, тем интенсивнее протекает гидролиз. Сущность процесса гидролиза можно представить следующим образом. Катионы соли образуют с молекулами воды донорно-акцепторные связи, причем донором являются атомы кислорода в молекулах воды, имеющие по две неподеленные электронные пары, а акцепторами - катионы, имеющие свободные электронные орбитали. Чем больше заряд катиона и меньше его размер, тем сильнее его поляризующее воздействие на гидратную оболочку и тем вероятнее, что катион оторвет от молекулы воды ион ОН-. Анионы соли связаны со своей гидратной оболочкой водородными связями, причем чем больше заряд аниона и меньше его paдиус, тем эти связи прочнее. В пределе анион может полностью оторвать протон от молекулы воды и образовать с ним ковалентную связь.
В общем случае реакция гидролиза является реакцией обратной реакции нейтрализации, поэтому возможность ее протекания определяется возможностью образования слабых электролитов, т.е. слабых кислот или слабых оснований.
Возможны четыре варианта действия воды на соль.
1.Соль (КС1) образована сильным основанием и сильной кислотой:
КС1 + Н2О = НС1 + КОН
В этом случае продуктами реакции являются сильные электролиты, которые в растворе в молекулярном виде существовать не могут. Равновесие полностью смещено влево, в сторону образования единственного слабого электролита, – воды.
В этом случае реакция гидролиза не идет. Концентрация ионов водорода и ионов гидроксида не изменится, и среда останется нейтральной.
2.Соль (К2СОЗ) образована сильным основанием и слабой кислотой:
(МУ) К2СОЗ + 2Н20 = Н2СОЗ + 2КОН
(ИМУ) 2K+ + CO32- + 2Н20 = Н2СОЗ + 2K+ + 2OH-
Среди продуктов реакции в растворе в виде молекул может существовать только угольная кислота (Кд = 4,69∙10-11), поэтому гидролиз идет ступенчато по аниону.
1 ст. CO32-+ Н0Н = НСОЗ- + OH- К2СОЗ + НОН = КОН + КНСОЗ
2 ст. НСОЗ- + Н0Н = Н2СОЗ + OH-КНСОЗ + НОН = КОН + Н2СОЗ
Появление в растворе избытка ионов OH- создает в растворе щелочную среду (рН > 7).Чем слабее кислота, тем интенсивнее идет гидролиз.
З.Соль (А1С13) образована слабым основанием и сильной кислотой
А1С13 + 3НОН = А1(ОН)3 + 3НС1
в этом случае гидролиз протекает по катиону, так как гидроксид алюминия является слабым электролитом (Кд = 1,38∙10-9)
1 ст. Al3++ HOH = АlOH2+ + Н+ А1С13 + НОН = А1(ОН)Cl2 + НС1
2 ст. АlOH2+ + HOH = Аl(OH)2+ + Н+ А1(ОН)Cl2 + НОН = А1(ОН)2Cl + НС1
3 ст. Аl(OH)2+ + HOH = Аl(OH)3 + Н+ А1(ОН)2Cl + НОН = А1(ОН)3 + НС1
Образовавшиеся в результате гидролиза ионы водорода делают среду кислой (рН < 7). Чем слабее образующееся основание, тем полнее идет гидролиз.
4.Соль (NH4CN) образована слабым основанием и слабой кислотой. В этом случае гидролиз идет и по катиону и по аниону:
NH4CN + НОН = NH40H + HCN
NH4+ + CN- = NH40H + HCN
Ионы Н+ и OH- в суммарное уравнение гидролиза не входят, хотя среда может оказаться и кислой и щелочной. Это зависит от относительной силы образовавшихся кислоты и основания. В приведенном примере у NH40H Кд = 1,79∙10-5, а у HCN Кд = 7,9∙10-10. Это свидетельствует о том, что цианистоводородная кислота является более слабым электролитом и, значит, гидролиз по аниону будет протекать более интенсивно. Образующиеся при этом ионы ОН- будут иметь большую концентрацию, чем ионы Н+. Раствор цианистого аммония имеет слабощелочную среду.
Гидролизом солей слабых многоосновных кислот по второй и третьей ступени обычно можно пренебречь.
Количественно процесс гидролиза характеризуется степенью гидролиза aг и константой гидролиза Кг. Степень гидролиза - это отношение числа частиц, подвергшихся гидролизу, к их общему растворенному количеству.
aг = 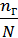 (7.20)
(7.20)
Степень гидролиза при нормальной температуре обычно величина очень маленькая. Для первого случая aг стремится к 0. В случаях 2 и 3 aг не превышает 1%. В четвертом случае она может достигать 3%.
Для реакции гидролиза КА + НОН = КОН + НА константа равновесия имеет следующий вид:
Кс = 
Так как для разбавленных растворов концентрация воды [НОН] является величиной постоянной, то произведение К на [НОН] также const и называется константой гидролиза:
Кг = 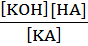 (7.21)
(7.21)
Для гидролиза по аниону (случай KCN) это уравнение примет вид
Kг = 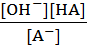 (7.22)
(7.22)
Учитывая, что Kw= [Н+][ОН-], можно заменить [ОН-] на Kw/[Н+]. Уравнение (7.22) примет вид
Кг =  (7.23)
(7.23)
Выражение [HA] /[A-][H+] = 1/Кдкис подставим в ур.7.23 и получим
Кг = 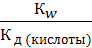 . (7.24)
. (7.24)
Аналогично для процесса гидролиза по катиону имеем
Кг = 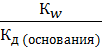 . (7.25)
. (7.25)
Для процесса гидролиза по катиону и аниону
Кг =  . (7.26)
. (7.26)
Взаимосвязь степени и константы гидролиза аналогичны взаимосвязям для степени и константы диссоциации (з-н разведения Оствальда).
При нагревании степень гидролиза возрастает, так как константа диссоциации воды с ростом температуры возрастает сильнее, чем константы диссоциации кислот и оснований.
Дата добавления: 2021-01-26; просмотров: 515;











