КЛАССИФИКАЦИЯ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ
Основой для классификации ОВР служит местоположение окислителя и восстановителя.
1.Межатомные или межмолекулярные ОВР. Окислитель и восстановитель входят в состав разных веществ.
2Zn0 + O20 = 2Zn+2O-2
2 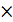 Zn - 2
Zn - 2  = Zn+2 – окисление атома цинка
= Zn+2 – окисление атома цинка
O2 + 4  = 2O-2 – восстановление молекулы кислорода.
= 2O-2 – восстановление молекулы кислорода.
2Zn + O2 = 2Zn2+ + 2O22-
2ZnO
H2S-2 + 2HN+5O3 = S0 + 2N+4O2 + 2H2O
H2S - 2  = S + 2H+ - окисление серы в молекуле H2S
= S + 2H+ - окисление серы в молекуле H2S
2 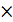 NO3- +2H+ +
NO3- +2H+ +  = NO2 + H2O - восстановление азота в ионе NO3-
= NO2 + H2O - восстановление азота в ионе NO3-
H2S + 2NO3- + 4H+ = S + 2H+ + 2NO2 + 2H2O
H2S + 2NO3- + 2H+ = S + 2NO2 + 2H2O
2.Внутримолекулярные ОВР. Окислитель и восстановитель входят в состав одного вещества.
2KCl+5O3-2 = 2KCl- + 3O20
2 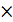 Cl+5 + 6
Cl+5 + 6  = Cl- восстановление атома хлора до иона Cl-
= Cl- восстановление атома хлора до иона Cl-
 2O-2 - 4
2O-2 - 4  = O20 окисление атомов кислорода до молекулы О2
= O20 окисление атомов кислорода до молекулы О2
2Cl+5+ 6O-2 = 2Cl- + 3O20
2ClO3-
3.Реакции диспропорционирования (дисмутации, самоокисления-самовосстановления). Окислителем и восстановителем являются атомы одного и того же элемента, находящиеся в промежуточной степени окисления и входящие в состав одного вещества. Часть атомов повышает свою степень окисления, а другая часть ее понижает.
3HN+3O2 = HN+5O3 + 2N+2O + H2O
2 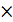 N+3 +
N+3 +  = N+2 восстановление
= N+2 восстановление
N+3 - 2  = N+5 окисление
= N+5 окисление
3 N+4 = 2N+2 + N+5
4.Реакции контрпропорционирования (конмутации). Реакция относится к внутримолекулярному типу. В результате происходит выравнивание степеней окисления атомов одного элемента, входящих к состав одного вещества и имеющих разные степени окисления.
N-3H4N+5O3 = N2+1O + 2 H2O
N+5 + 4  = N+1 восстановление
= N+1 восстановление
N-3 - 4  = N+1 окисление
= N+1 окисление
N+5 + N+3 = 2 N+1
NH4NO3 = N2O
Дата добавления: 2021-01-26; просмотров: 467;











