РАВНОВЕСНЫЕ ПРОЦЕССЫ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ
1. ДИССОЦИАЦИЯ СЛОЖНЫХ ЭЛЕКТРОЛИТОВ.
Диссоциация сложных электролитов протекает ступенчато.
Рассмотрим это явление на примере ортофосфорной кислоты:
1ст. НЗР04 = H+ + Н2Р04- К1=7,11∙10-3
2ст. H2P04- = Н+ + НР04-2 К2=6,34∙10-8
Зст. НР042- = Н++ Р043- К3=4,40∙10-13
Происходит последовательный отрыв ионов водорода. Каждая из ступеней характеризуется своей константой диссоциации. Каждая последующая константа примерно на 5 порядков меньше предыдущей, что свидетельствует о возрастании затрудненности процесса. Видно, что наиболее легко происходит отрыв первого протона, затем отрицательный заряд кислотного остатка возрастает и ионы Н+ отрываются все тяжелее и тяжелее. Поэтому в разбавленных растворах фосфорной кислоты фосфат ионов (Р043- ) очень мало. Для многоосновных кислот в большинстве случаев процесс диссоциации ограничивается первой ступенью.
2. ДИССОЦИАЦИЯ КИСЛОТ И ОСНОВАНИЙ.
Теория Аррениуса позволила сформулировать первую теорию кислот и оснований. Согласно ей кислотой является соединение, диссоциирующее на ионы водорода и кислотного остатка:
НАn ↔ Н+ + An- Кд =  ,
,
Основание - это соединение, диссоциирующее на катионы металла и анионы гидроксида
МeОН ↔ Мe+ + ОН- Кд = 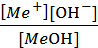
Количественной мерой силы кислот и оснований является константа их диссоциации. Чем больше константа, тем более сильным электролитом является вещество и, значит, тем сильнее кислота или основание.
В ряду кислот наиболее сильной будет та, которая при одинаковой молярности даст в раствор наибольшее
число ионов водорода, т.е. чем больше степень диссоциации кислоты, тем она сильнее. То же можно сказать и в отношении оснований. Чем больше a, тем больше гидроксильных групп основание дает при диссоциации, тем оно сильнее. Таким образом, степень диссоциации также является мерой силы кислоты и оснований.
Взаимодействие между кислотой и основанием с образованием соли и воды называется реакцией нейтрализации. Экспериментально было определено, что тепловой эффект этой реакции в расчете на 1 моль воды не зависит от природы кислоты и основания. Этот факт до Аррениуса не имел объяснения, так как тепловой эффект для каждой реакции является ее абсолютной принадлежностью. Оказалось, что реакция нейтрализации по своей природе является реакцией образования только воды, а соль в молекулярном виде в растворе существовать
не может, так как является очень сильным электролитом.
HCl + NaOH = NaCl + H2O.
В данной реакции все вещества, кроме воды, являются сильными электролитами и в растворе существуют в виде ионов:
H+ + Cl- + Na+ + OH- = Na+ + Cl- + H2O
Из уравнения видно, что в реакцию вступили только ионы водорода и гидроксида: H+ + OH- = H2O
Тепловой эффект этой реакции составляет 57,3 кДж/моль и не зависит от природы кислоты и основания.
Теория кислот и оснований, сформулированная в рамках теории Аррениуса, имеет ряд существенных ограничений. Эти ограничения были устранены в рамках протолитической теории Бренстеда – Лоури (1923г.) и электронной теории кислот и оснований Льюса (1924г.).
3. ДИССОЦИАЦИЯ ВОДЫ. Чистая вода обладает крайне незначительной электропроводностью и относится к разряду очень слабых электролитов
Н2О ↔ Н+ + ОН-
Образовавшиеся ионы являются гидратированными, причем ион водорода образует с молекулой воды ион гидроксония:
Н+ + Н2О = Н3О+
Константа диссоциации воды описывается уравнением
Кд = 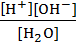 = 1,8/10-16 (7.14)
= 1,8/10-16 (7.14)
Учитывая, что степень диссоциации воды a<<1, можно считать, что [H2O]~const=55,56 моль/л. Объединив две константы, получим новую:
Кд .[H2O] = const = [H+][OH-] = Kw = 10-14.
Константа Kw – называется ионным произведением воды и зависит только от температуры. С повышением температуры диссоциация молекул воды усиливается и Kw увеличивается (при 00С Kw = 10-14,9; при 600С Kw = 10-13).
Учитывая, что носителем кислотных свойств являются ионы Н+, а основных ОН-, равенство концентраций этих ионов должно предполагать нейтральную среду.
[H+].= [OH-] = 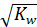 =10-7 моль/л (7.15)
=10-7 моль/л (7.15)
Для упрощения расчетов в 1909г Серенсен предложил пользоваться не самими величинами, а их отрицательными десятичными логарифмами и ввел в химию понятие водородного показателя pH = - lg [H+]. В чистой воде рН = - lg10-7= 7. В зависимости от концентрации ионов водорода была предложена шкала кислотности растворов - шкала рН. При стандартных условиях концентрация ионов водорода изменяется от 1 до 10-14 моль/л, а рН от 0 до 14.
[H+],моль/л 1
10-7 10-14
рН 0 7 14
рН<7 среда кислая, рН=7среда нейтральная, рН>7- среда щелочная.
Для идентификации кислотности среды используются либо приборные методы, либо кислотно-основные индикаторы. Эти вещества изменяют свою окраску в зависимости от рН раствора. Чаще всего индикаторы являются слабыми
органическими кислотами или основаниями и существуют в растворе в виде двух таутомерных форм, находящихся в равновесии. Эти формы отличаются друг от друга строением и могут переходить друг в друга при изменении рН. Изменение внутримолекулярного строения молекулы индикатора сопровождается изменением его окраски. Различают одноцветные (фенолфталеин) и двухцветные индикаторы (лакмус, метиловый оранжевый).
Таблица 7.2
Дата добавления: 2021-01-26; просмотров: 444;











