СОСТАВЛЕНИЕ УРАВНЕНИЙ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ
Для составления полного уравнения окислительно-восстановительной реакции необходимо знать свойства реагирующих веществ и на их основе определить продукты реакции. После этого надо подобрать стехиометрические коэффициенты реакции. Определение свойств веществ не входит в задачу данного пособия, поэтому будем считать, что молекулярная схема реакции известна.
Для подбора стехиометрических коэффициентов можно использовать несколько методов, из которых наиболее распространены два. Метод электронного баланса и метод электронно-ионных уравнений.
1. Метод электронного баланса является наиболее универсальным методом и применим для любых окислительно-восстановительных процессов, протекающих в любых системах (растворы, расплавы, газы). В основе метода лежит принцип сравнения степеней окисления атомов в исходных веществах и в продуктах реакции с последующим составлением схемы электронного баланса.
В качестве примера рассмотрим реакцию взаимодействия дихромата калия с сероводородом в кислой среде.
1.1.Молекулярная схема реакции со степенями окисления атомов.
K2+Cr2+6O7-2 + H2+S-2 + H2+S+6O4-2 = Cr2+3(S+6O4-2)3 + S0 + K2+S+6O4-2 + H2+O-2
1.2.Определяют атомы, изменившие свои степени окисления, и составляют схему перехода электронов от восстановителя к окислителю.
Cr+6 + 3  = Cr+3 (1)
= Cr+3 (1)
S-2 - 2  = S0 (2)
= S0 (2)
В данной реакции окислителем является атом хрома Cr+6, а восстановителем атом серы S-2.
Так как число электронов, отданных восстановителем и принятых окислителем, должно быть равно, оно уравнивается за счет изменения числа атомов, участвующих в данном электронном переходе. В приведенной схеме необходимо уравнение (1) умножить на 2, а уравнение (2) на 3, тогда будет принято и отдано по 6 электронов. После умножения уравнения складываются, как обычные алгебраические, а электроны сокращаются.
2 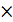 Cr+6 + 3
Cr+6 + 3  = Cr+3 восстановление
= Cr+3 восстановление
3 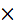 S-2 - 2
S-2 - 2  = S0 окисление
= S0 окисление
2Cr+6 +3S-2 = 2Cr+3 + 3 S0
1.3. Полученные коэффициенты называют основными. Они переносятся в молекулярную схему реакции и ставятся перед соответствующими веществами.
Так как в молекулах дихромата калия и сульфата хрома содержится по два атома хрома, то двойки перед этими веществами опускаются.
K2Cr2O7 + 3H2S + H2SO4 = Cr2(SO4)3 + 3S + K2SO4 + H2O
1.4. Следующий этап заключается в подборе дополнительных коэффициентов, уравнивающих остальные вещества (за исключением H2S и S). Среди исходных веществ был 1 моль атомов серы (H2SO4), а среди продуктов 3+1 = 4 моль (Cr2(SO4)3 и K2SO4). Значит, перед серной кислотой должен быть коэффициент 4.
K2Cr2O7 + 3H2S + 4H2SO4 = Cr2(SO4)3 + 3S + K2SO4 + H2O
Слева 14 моль атомов водорода, справа – 2. Перед водой должен быть коэффициент 7.
K2Cr2O7 + 3H2S + 4H2SO4 = Cr2(SO4)3 + 3S + K2SO4 + 7H2O
Проверка количества остальных атомов показывает, что все коэффициенты подобраны.
2. Метод электронно-ионных уравнений (метод полуреакций) применяется для подбора коэффициентов в уравнениях реакций, протекающих в растворах. Метод оперирует с реально существующими в растворах частицами и позволяет учитывать влияние среды раствора (его кислотности, рН) на процессы окисления и восстановления частиц. В качестве частиц среды в водных растворах могут принимать участие следующие частицы.
Таблица 8.1
Дата добавления: 2021-01-26; просмотров: 394;











