Й Постулат. Электролиты при растворении распадаются на ионы не полностью, и поэтому только часть молекул присутствует в растворе в виде ионов.
Величина, характеризующая долю молекул, распавшихся на ионы в состоянии равновесия, называется степенью диссоциации (a).
a = 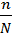 , (7.9)
, (7.9)
где n – число распавшихся на ионы молекул, N - общее количество растворенных молекул.
Степень диссоциации зависит от температуры, типа растворителя, от природы электролита и его концентрации. Условно принимают, что если a > 30%, то электролит считается сильным, если a < 3%, то электролит слабый. Чем выше концентрация раствора, тем степень диссоциации меньше, так как при увеличении концентрации усиливается процесс ассоциации ионов в молекулы.
Второй количественной характеристикой электролита является табличная величина, называемая константа диссоциации Кд, которая является константой равновесия в процессе электролитической диссоциации.
AnBm = nA m+ + mBn- Кд = 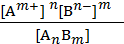 . (7.10)
. (7.10)
Если электролит бинарный, то АВ ↔ А+ + В-
Кд = 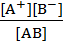 . (7.11)
. (7.11)
Обозначим исходную концентрацию электролита как С (моль/л), а степень его диссоциации a. Тогда концентрация катионов и анионов будут равны [A+] = [B-] = aC, a концентрация нераспавшейся части молекул [AB]=(1-a)  C. Подставим эти выражения в уравнение для константы диссоциации (11.7), получим
C. Подставим эти выражения в уравнение для константы диссоциации (11.7), получим
Кд= 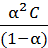 . (7.12)
. (7.12)
Это уравнение было получено Оствальдом и выражает закон разведения. Константа диссоциации, в отличие от степени диссоциации, не зависит от концентрации и определяется природой электролита и температурой. Для очень слабых электролитов a → 0 и выражение (12.7) преобразуется в более простое:
Кд= a2С . (7.13)
Соотношение (13.7) справедливо только для слабых симметричных бинарных электролитов. В более сложных случаях это выражение усложняется.
Дата добавления: 2021-01-26; просмотров: 496;











