Реакции спиртовых гидроксилов
Из наиболее характерных свойств спиртовых гидроксигрупп в моносахаридах следует отметить реакции этерификации, ведущие к образованию сложных эфиров карбоновых и минеральных кислот.
Сложные эфиры.
Подбирая стехиометрические соотношения реагентов, можно получить различные по числу ацильных остатков сложные эфиры. При полном ацетилировании гексоз образуются пентаацетаты. Эта реакция широко используется в химии углеводов для количественного определения числа гидроксигрупп.
В зависимости от условий ацетилирования можно получить преимущественно пентаацетат одного аномера. Например, при ацетилировании D–глюкозы уксусным ангидридом в среде пиридина образуется пентаацетат β-D-глюкопиранозы:
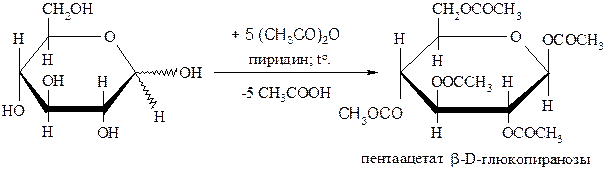
Обозначение связи в циклических формах пунктирной линией указывает на то, что имеется в виду смесь α- и β-аномеров, или же положение полуацетального гидроксила не ясно.
Эфиры моносахаридов, содержащие остатки фосфорной кислоты имеют важное биологическое значение. Обычно в природе распространены фосфаты моносахаридов, содержащих остаток фосфорной кислоты либо у первичного гидроксила, например, глюкозо-6-фосфат, либо у гликозидного гидроксила – α-D-глюкозо-1-фосфат:
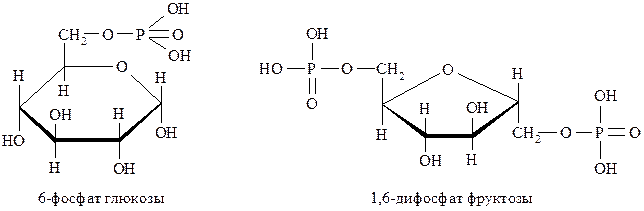
Метилирование. Использование в качестве метилирующих агентов йодистого метила или диметилсульфата в среде диметилформамида или диметилсульфоксида позволяет получить сполна метилированный продукт. Провести избирательное метилирование моносахарида не удаётся, поскольку в условиях реакции различия в свойствах гидроксигрупп проявляются очень слабо. Наибольшей активностью отличается полуацетальный гидроксил, который метилируется в первую очередь. Из остальных гидроксигрупп наиболее активны первичноспиртовый и С2–ОН. Обычно при метилировании образуются производные обоих аномеров, что показано на примере глюкозы:
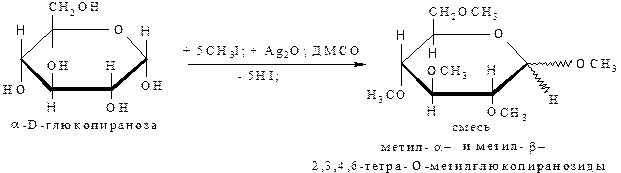
В метилированном продукте в положениях 2,3,4,6 образуется простая эфирная связь, которая, как известно, устойчива к действию разбавленных кислот и оснований. Совсем иное поведение метоксигруппы у аномерного углеродного атома (положение С-1) – при действии разбавленной кислоты эта связь очень легко расщепляется с образованием свободного полуацетального гидроксила:
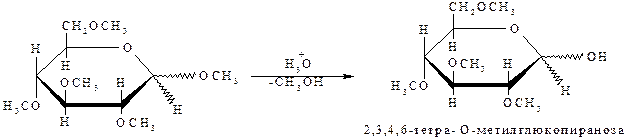
Химическая связь между аномерным атомом углерода моносахарида и остатком другого компонента называется гликозидной. Соединения, образованные путём замещения полуацетального гидроксила на различные заместители, называются гликозидами.
Следовательно, в пентаметилпроизводном моносахарида связи с участием спиртовых гидроксигрупп у С-2, С-3, С-4 и С-6 являются простыми эфирными, а с участием полуацетального гидроксила – гликозидной.
По этой причине полуацетальный гидроксил принято называть гликозидным гидроксилом.
При действии окислителей легче всего и в первую очередь окисляется аномерный центр с образованием альдоновых кислот (разд. 22.3.1.).
Путём избирательного окисления первичноспиртовой группы можно получить соответствующие уроновые кислоты. В этом случае необходима предварительная защита полуацетального гидроксила переводом моносахарида в гликозид.
Окисление проводят кислородом в присутствии платиновых катализаторов:
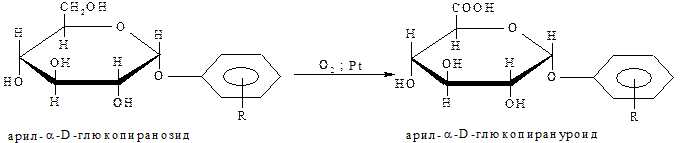 Далее защиту гликозидного гидроксила снимают действием разбавленной минеральной кислоты (HCl или H2SO4). Уроновые кислоты в отличие от альдоновых и аровых (сахарных) кислот являются производными моносахаридов и представляют собой полигидроксиальдегидокислоты, способные существовать в циклических полуацетальных формах:
Далее защиту гликозидного гидроксила снимают действием разбавленной минеральной кислоты (HCl или H2SO4). Уроновые кислоты в отличие от альдоновых и аровых (сахарных) кислот являются производными моносахаридов и представляют собой полигидроксиальдегидокислоты, способные существовать в циклических полуацетальных формах:

Расположенные у двух соседних атомов углерода две гидроксигруппы (виц-диолы) способны взаимодействовать с альдегидами и/или кетонами. Эти реакции реализуются под контролем стереохимических факторов: в реакцию могут вступать только те пары гидроксигрупп, которые отстоят друг от друга до 0,3 нм, или же те, которые могут сближаться, не вызывая искажения конформации молекулы.
Если в качестве карбонильного реагента использовать, например, ацетон, то образуются изопропилиденовые производные.
Когда в реакции участвует цис-1,2-диольная группа, то образуется 1,3-диоксолановый цикл, который по существу представляет собой кеталь:
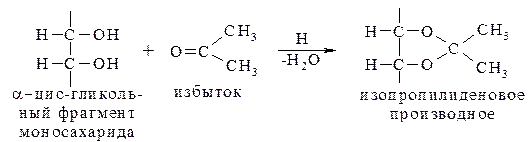
Дата добавления: 2020-10-01; просмотров: 779;











