Реакции электрофильного замещения в ароматическом ядре
Реакции электрофильного замещения в ароматическом ядре протекают очень легко из-за активирующего влияния гидроксильной группы, которая, будучи заместителем I рода, преимущественно направляет входящий заместитель в орто- и пара- пололжения.
Галогенирование фенолов происходит легко и для этого катализатор не требуется.
Особо следует отметить реакцию бромирования: при действии бромной воды образуется 2,4,6–трибромфенол, который плохо растворим в воде и выделяется в виде белого творожистого осадка. Данная реакция протекает количественно, поэтому может использоваться не только как качественная, но и в количественном анализе.
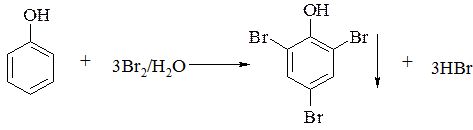
Нитрование разбавленной азотной кислотой (20-25%) приводит к образованию смеси орто- и пара – нитрофенолов:
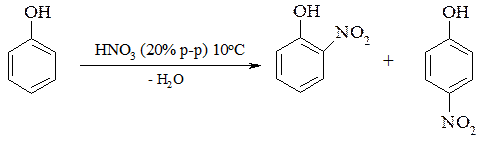
Характерной особенностью орто–нитрофенола является наличие внутримолекулярной водородной связи, благодаря чему он легко перегоняется с водяным паром. Эта особенность позволяет использовать данный метод для разделения орто- и пара-изомеров.
Нитрозированиефенолов осуществляют с помощью азотистой кислоты либо в воде, либо в среде уксусной кислоты (для водонерастворимых фенолов).
Эта реакция характеризуется высокой избирательностью по отношению к пара-положению: соотношение пара- и орто - нитрозофенолов составляет 15:1 :
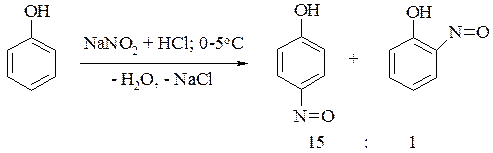
Сульфирование фенолов приводит к фенолсульфоновым кислотам. Температурный фактор играет важную роль в соотношении о- и п- изомеров. Так, при действии конц. H2SO4 на фенол орто – изомер преобладает, если to < 100oC. Повышение температуры выше 100o C способствует перегруппировке орто – изомера в пара – изомер:
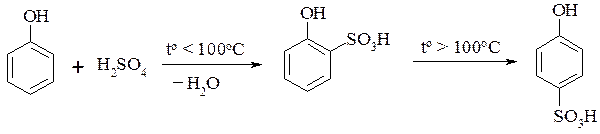
Карбоксилирование проводится действием СO2 на сухой фенолят натрия. Реакция открыта Г. Кольбе и усовершенствована Р. Шмиттом. Реакция Кольбе-Шмитта лежит в основе синтеза салициловой кислоты:
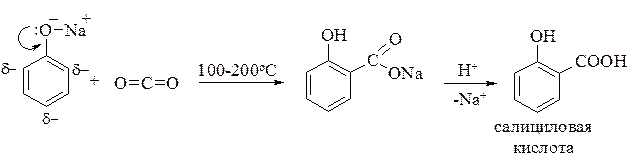
Алкилирование по Фриделю-Крафтсу приводит обычно к орто- и пара- изомерам. В качестве алкилирующих агентов используют спирты и алкены в присутствии протонных кислот или кислот Льюиса:
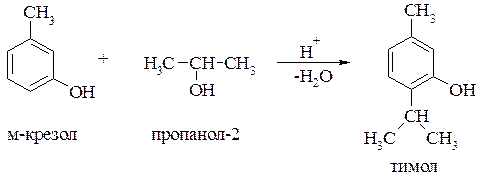
Ацилирование по Фриделю-Крафтсу приводит к гидроксикетонам. Ацилирующими реагентами служат ангидриды или хлорангидриды, а катализа- торы – кислоты Льюиса.
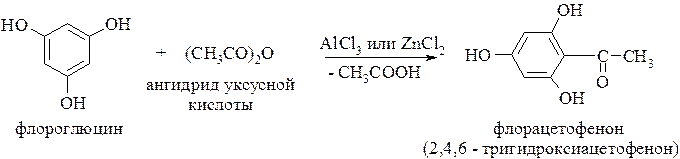
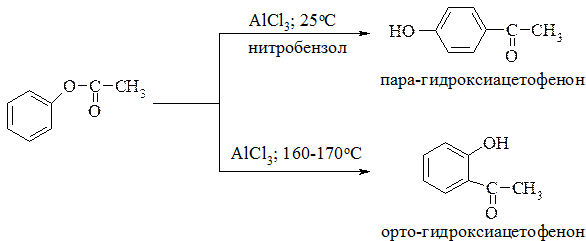
Более распространённым методом ацилирования является перегруппировка Фриса: сложные эфиры фенолов при нагревании в присутствии хлорида алюминия переходят в орто- или пара- гидроксикетоны. Преимущественное образование орто- или пара- изомеров определяется природой растворителя и температурным режимом: если процесс вести в нитробензоле, то при температуре 20-25оС ацильный остаток перегруппировывается в пара- положение, а в более жёстких условиях (выше 150-160оС) преобладает орто- изомер:
Формилирование(введение альдегидной группы) осуществляется взаимодействием фенола с большим избытком хлороформа и водным раствором гидроксида натрия или калия. Данная реакция, как правило, приводит к орто – гидроксиальдегидам и известна как реакция Раймера-Тимана:
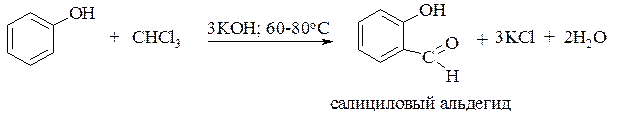
Взаимодействие с формальдегидом (гидроксиметилирование). Фенол в кислой или щелочной средах образует гидроксибензиловые спирты:

Далее эти соединения конденсируются друг с другом, образуя в конечном итоге трёхмерные сетчатые структуры, которые представляют собой фенолформальдегидные смолы (карболит или бакелит)
Фенопласты широко используют в технике в качестве заменителей пластмасс.
Гидрирование
При каталитическом гидрировании фенола образуется циклогексанол, который находит широкое применение в промышленном синтезе капролактама, и далее – капрона.
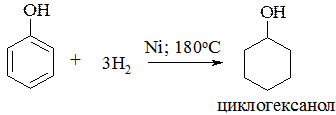
Резорцин восстанавливается до дигидропроизводного, которое легко трансформируется в дикетон:

13.3.5. Окисление
Фенолы сравнительно легко окисляются и механизм окисления зависит от природы одно- или двухэлектронного окислителя. При окислении двухэлектронным окислителем – дихроматом калия или оксидом марганца (IV) в кислой среде образуется п-хинон (п-бензохинон):
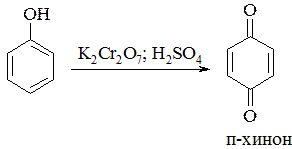
Предполагается, что фенол, взаимодействуя с хромовой кислотой, образует сложный эфир, который далее отщепляет анион HCrO3¯ и превращается в карбокатион. Последний подвергается гидратации с образованием гидрохинона, который затем окисляется до п-хинона:
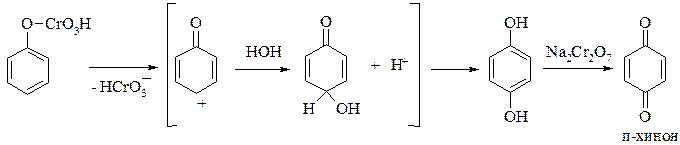
При одноэлектронном процессе окисления образуется феноксильный радикал, который димеризуется:
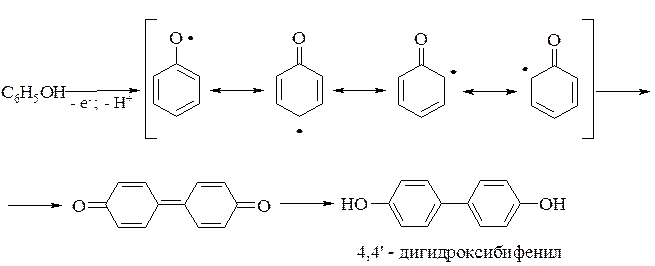
Если в оба орто- положения ввести объёмные заместители, то образующийся феноксильный радикал становится устойчивым и в отсутствии воздуха и агрессивных окислительных реагентов может существовать длительное время. Примером такого соединения является 2,6–ди-трет-бутил–4–метилфенол:
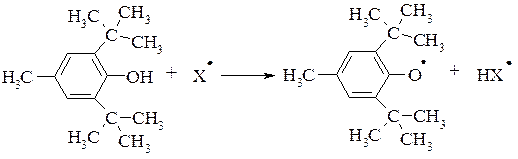
Данный механизм лежит в основе антиоксидантных свойств фенолов.
Дата добавления: 2020-10-01; просмотров: 694;











