Химические свойства
Гидроксильная группа является электронодонорным заместителем, у которого положительный мезомерный эффект преобладает над отрицательным индуктивным эффектом (+М>-I).
р-Орбиталь с неподелённой парой электронов атома кислорода взаимодействует с π-электронами ароматического ядра (р,π-сопряжение). Вследствие этого электронная плотность в орто- и пара- положениях повышается и поэтому SE-реакции протекают значительно легче по сравнению с бензолом.
Благодаря р,π–сопряжению энергии и длины связей С-ОН и О-Н в фенолах существенно отличаются от таковых в спиртах: связь С-ОН в фенолах значительно короче (0,136 нм), чем у спиртов (0,142 нм), поэтому энергия связи С-ОН у фенолов гораздо больше (430 кДж/моль), чем у спиртов (380 кДж/моль). Связь О-Н в фенолах гораздо более полярна и легче поляризуема, чем в спиртах.
Таким образом, химические свойства фенолов с одной стороны обусловлены наличием ОН-группы, а с другой – наличием бензольного ядра, способного к взаимодействию с электрофильными реагентами.
Необходимо отметить, что в фенолах гидроксильная группа значительно менее подвижна, чем в спиртах.
В целом же реакции с участием фенолов предпочтительно рассматривать как с точки зрения участия гидроксильной группы, так и наличия ароматического ядра с учётом их взаимного влияния.
Кислотные свойства
Фенолы являются намного более сильными кислотами, чем спирты. Так, для фенола рКα=9,7, что на 8 порядков меньше, чем рКα алифатических спиртов:
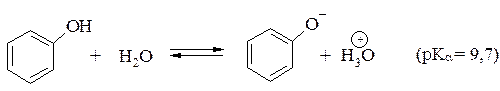
Фенолы в водных растворах щелочей образуют феноляты:
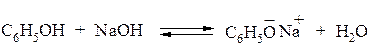
В анионе (феноксид-анионе) отрицательный заряд делокализован между атомом кислорода и атомами углерода в орто - и пара – положениях бензольного ядра. Таким образом, феноксид-анион представляет собой типичный амбидентный ион, т.е ион, содержащий два реакционных центра, образующих единую сопряжённую систему (атом кислорода и атомы углерода в орто- или пара - положениях).
Электроноакцепторные заместители в ароматическом ядре усиливают кислотность фенольного гидроксила. Так, для 2.4.6 – тринитрофенола (пикриновой кислоты) рКα=1.5, т.е. по силе она очень близка к соляной кислоте.
Дата добавления: 2020-10-01; просмотров: 454;











