Физические свойства
Диметиловый и метилэтиловый эфиры в обычных условиях – газы. Начиная с диэтилового эфира и далее по мере увеличения молекулярной массы вещества представляют собой легколетучие жидкости с характерным запахом.
Температуры кипения простых эфиров гораздо ниже, чем у соответствующих спиртов. Объясняется это отсутствием межмолекулярных водородных связей. Простые эфиры по-разному растворимы в воде: растворимость диэтилового эфира составляет 7,5 г на 100 г воды, а диметиловый эфир и тетрагидрофуран хорошо смешиваются с водой.
Химические свойства
Анализ значений валентных углов С–О–С в простых эфирах свидетельствует о том, что в диалкиловых эфирах он приближается к тетраэдрическому и равен 109-112о.
В алкилариловых и диариловых эфирах валентный угол близок к 120о. По этой причине дипольные моменты связей С–О–С не компенсируют друг друга (молекула не линейная). Алкильные радикалы проявляют +I-эффект, благодаря чему связь С–О полярна. Длина связи С–О несколько меньше, чем С–С в алканах. Простые эфиры обладают более сильными электронодонорными свойствами, чем спирты, что объясняется влиянием двух алкильных радикалов (+I-эффект).
Основные свойства
На атоме кислорода имеются неподелённые пары электронов, поэтому эфиры могут проявлять свойства жёстких оснований (согласно определению Льюиса). В то же время нуклеофильность этого реакционного центра повышена из-за влияния алкильных радикалов.
Все эти особенности строения свидетельствуют о том, что простые эфиры способны в присутствии сильных кислот (серная, хлороводородная и т.д.) протонироваться с образованием солей оксония:

Такие оксониевые соединения представляют собой соли слабого основания – эфира и сильной кислоты и поэтому гидролизуются при разбавлении водой с выделением эфира.
Кислоты Льюиса, например, BF3, SnCl4, ZnCl2, MgCl2 с простыми эфирами образуют так называемые эфираты, которые по сути представляют собой оксониевые соединения. Они отличаются значительной устойчивостью:
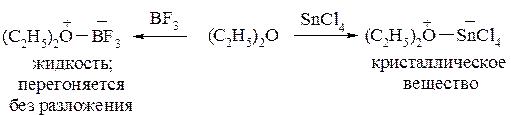
В эфиратах связь между атомом кислорода и кислотой Льюиса осуществляется за счёт неподелённой пары электронов кислорода, т.е. по донорно-акцепторному механизму.
Дата добавления: 2020-10-01; просмотров: 517;











