Реакции электрофильного замещения
π-Электронная система бензола восприимчива к атаке электрофильными реагентами. Для бензола наиболее характерны реакции электрофильного замещения (SE). Данный тип реакций можно представить в общем виде:

Электрофильные реагенты условно делят на три группы: сильные, средние и слабые.
К сильным электрофилам относят NO2+, комплексы галогенов с кислотами Льюиса – Br[FeBr4].
К электрофилам средней силы относятся комплексы кислот Льюиса с алкил- или ацилгалогенидами – Alk[AlCl4]; Ac[AlCl4].
Слабыми электрофилами являются катион нитрозония – NO+; оксид углерода (IV) – СО2, а также катион диазония Ar–N+≡N.
Взаимодействие электрофильной частицы с бензольным ядром сопровождается вначале образованием так называемого π-комплекса:
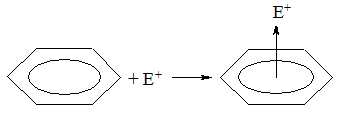
π-комплекс
Характерной особенностью π-комплекса является то, что электрофильная частица не связана ковалентной связью с каким-то конкретным углеродным атомом бензольного ядра. π-Комплекс можно представить как результат слабого электростатического взаимодействия между электрофильной частицей (акцептор электронов) и π-электронной системой бензольного ядра (донор электронов). Формирование и расщепление π-комплекса протекает очень быстро.
Следующей стадией является образование σ-комплекса, в котором один из шести углеродных атомов бензольного ядра переходит в sp3-гибридное состояние и образует ковалентную связь с электрофильной частицей. Это становится возможным, потому что электрофильная частица акцептирует два электрона из шести π-электронов бензольного ядра. Оставшиеся четыре делокализованных π-электрона распределены между пятью sp2-гибридными углеродными атомами, в то время как шестой атом углерода переходит в насыщенное, sp3-гибридное состояние. Важно отметить, что из двух электронов, участвующих в образовании ковалентной связи между электрофильной частицей и углеродным атомом, один принадлежит данному атому углерода, а второй – переходит от негибридной p-орбитали одного из двух орто- или пара-углеродных атомов.
Таким образом, σ-комплекс имеет природу карбкатиона, в котором положительный заряд сосредоточен на одном из указанных трёх углеродных атомах:
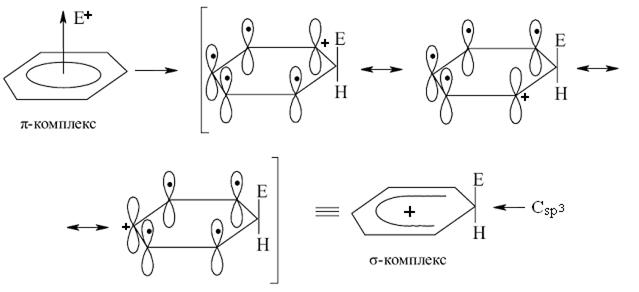
Далее от σ-комплекса отщепляется ион Н+, что достигается за счёт гетероциклического разрыва связи С–Н у sp3-гибридизованного атома углерода. Оставшаяся у этого атома пара электронов вместе с четырьмя делокализоваными электронами пяти атомов углерода бензольного ядра вновь формируют секстет π-электронов, т.е. происходит реароматизация и образуется конечный продукт.
Следует обратить внимание на тот факт, что образование π-комплкса не требует каких-либо значимых энергетических затрат.
Стадией, определяющей скорость процесса, в большинстве случаев является образование σ-комплекса. Такой вывод обоснован потому, что именно на данном этапе происходит деароматизация системы.
Примерами SE-реакций являются галогенирование, нитрование, сульфирование, алкилирование, ацилирование.
Галогенирование
Реакция осуществляется в присутствии катализаторов, роль которых сводится к поляризации молекулы галогена с последующим образованием электрофильной частицы Br+:
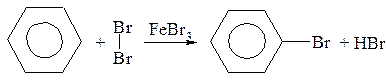
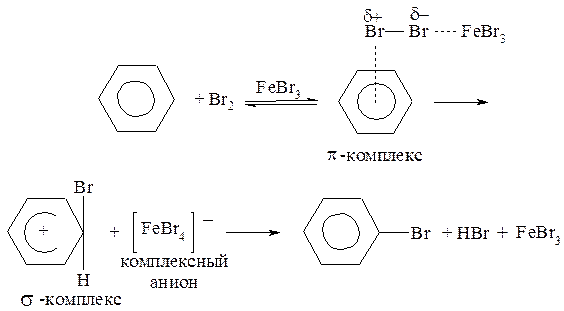
Нитрование
Электрофильной частицей в этой реакции является катион нитрония [NO2]+, который образуется в нитрующей смеси:
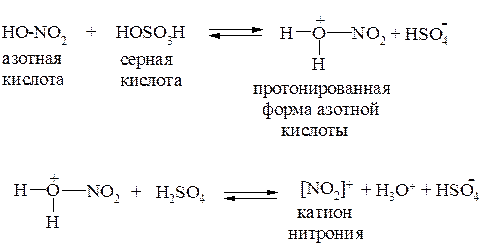

Сульфирование
Сульфирующим реагентом в данной реакции является оксид серы (VI) и с этой целью используют олеум (раствор SO3 в H2SO4). Реакция идёт через такие же стадии, что и нитрование и галогенирование:

Дата добавления: 2020-10-01; просмотров: 646;











