Газовые законы в химии
Многие вещества (кислород, водород, азот, углекислый газ, аммиак и др.) существуют в газообразном состоянии. Состояние газа описывается определенными законами. Экспериментально установлено, что все газы (при постоянной температуре) одинаково сжимаются (закон Бойля-Мариотта:PV = constилиР1V1 = P2V2) и обладают одинаковым термическим коэффициентом расширения (законы Гей-Люссака и Шарля: 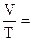 constпри постоянном давлении и
constпри постоянном давлении и 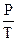 = const при постоянном объеме). Сочетание этих законов находит свое выражение в уравнении Клапейрона:
= const при постоянном объеме). Сочетание этих законов находит свое выражение в уравнении Клапейрона:
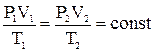
Уравнение Клапейрона используется для приведения объемов газов от одних условий (температуры и давления) к другим.
На основе этих газовых законов и своих наблюдений Авогадро сформулировал следующий закон (1811): в равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул.
Если взять 1 моль любого газа, то легко убедиться измерением объемов, что при нормальных условиях он займет объем 22,4 л. Это мольный (или молярный) объем газа.Эта постоянная величина, обозначается Vm, единича измерения – л/моль.
Нормальные условия в Международной системе единиц (СИ): давление 1,013×105 Па (в других единицах давления это 760 мм рт.ст. или 1 атм.); температура 273 К (0 ºС).
Если условия отличаются от нормальных, мольный объём имеет другое значение, для расчетов которого можно воспользоваться уравнением Клапейрона–Менделеева:
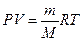 ,
,
где Р - давление газа, V - объем, m - масса газа, М - молярная масса, Т - температура (К), R - молярная (универсальная) газовая постоянная, численное выражение которой зависит от единиц, определяющих объем газа и его давление.
В системе СИ: R = 8,314 Дж/моль·К или 8,314 Па×м3/ моль×К.
Для внесистемных единиц измерения давления и объема величина R имеет значения:
R = 62400 мм рт. ст.×мл/моль×К; R = 0,082 атм×л/моль×К; R = 1,99 кал/моль·К.
Газовые законы сыграли большую роль в установлении атомно-молекулярного учения и в разработке молекулярно-кинетической теории газов. В настоящее время они широко используются в химических расчетах, когда в реакциях участвуют и (или) образуются газообразные вещества.
Пример 4. Найти массу 200 л хлора при н.у.
Решение. 1 моль газообразного хлора (Сl2) имеет массу 71 г и занимает объем 22,4 л. Составляем и решаем пропорцию:
71 г - 22,4 л
Х г - 200 л Х = 200∙71/ 22,4 = 633,2 г.
Дата добавления: 2016-07-05; просмотров: 4112;











