Уравнения химических реакций
Химические реакции записывают в виде особых (химических) уравнений, в которых каждый символ атома или молекулы обозначает атом (молекулу) или один их моль. Знак равенства между реагентами и продуктами отражает закон сохранения массы вещества в химических реакциях и, как следствие, тот факт, что число атомов каждого элемента среди реагентов равно числу таких же атомов среди продуктов. Например, химическое уравнение реакции
2Н2 + О2 = 2Н2О
реагенты продукты
означает, что 2 молекулы водорода Н2 (4 атома Н) взаимодействуют с одной молекулой О2 (2 атома О) и при этом получается 2 молекулы воды, в которых столько же атомов Н (4) и О (2), сколько их было в реагентах. Для практических расчётов важнее то, что уравнение показывает количества взаимодействующих и образующихся веществ: два моля водорода Н2 взаимодействуют с одним молем кислорода О2 и при этом получается два моля воды.
Коэффициенты перед формулами в уравнении реакции называются стехиометрическими; они относятся ко всем атомам формулы (коэффициент 1 не пишется, т.к. сама формула означает один моль вещества). Кроме того, в химических уравнениях сохраняется заряд; это важно при написании уравнений ионных и окислительно-восстановительных реакций (см. разд. 6 и 7).
При написании химического уравнения сначала записывают его схему без стехиометрических коэффициентов, например
Н2 + N2 ® NH3,
а затем уравнивают его. Общий метод уравнивания заключается в составлении уравнений баланса всех атомов. Для этого записывают химическое уравнение с неизвестными коэффициентами:
х1Н2 + х2N2 = x3NH3,
а затем - алгебраическую систему уравнений баланса по атомам:
1) 2х1 = 3х3 (по атомам Н)
2) 2х2 = х3 (по атомам N)
Система не имеет определенного решения, так как не хватает одного уравнения. Решая эту систему, находим:
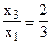 и
и 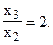
Принимая далее один из коэффициентов равным 1, например х2 = 1 (это и будет третье уравнение системы), находим, что х3 = 2 и х1 = 3.
Таким образом, получим уравнение:
3Н2 + N2 = 2NH3
Если получаются дробные коэффициенты, то их обычно приводят к наименьшему целому.
Другие способы уравнивания будут рассмотрены в разделе 7.1.1.
Уравнение химической реакции замечательно тем, что по нему можно найти количества и массы всех реагирующих и получающихся веществ, если известно количество или масса хотя бы одного из них и если реакция протекает нацело.
Пример 21. Рассчитать массу 30%-й соляной кислоты, необходимой для разложения одного кг СаСО3. Определить объем СО2(н.у.), выделяющегося при этом.
Решение. Записываем уравнение реакции и молярные массы реагентов:
СаСО3 + 2НСl = CaCl2 + CO2 + H2O; М(СаСО3) = 100 г/моль, М(НCl) = 36,5 г/моль.
Из уравнения делаем вывод, что 1 моль СаСО3 взаимодействует с 2 моль кислоты и при этом выделяется 1 моль СО2. На этом основании можно составить пропорции:
1) 100 г СаСО3 взаимодействуют с 2·36,5 г НСl
1000 г СаСО3 взаимодействует с Х г НСl
Отсюда Х = 720 г HCl – это масса хлороводорода в чистом виде, а масса 30%-й соляной кислоты m равна:
m = 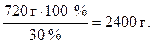
2) При взаимодействии 100 г CaCO3 выделяется 22,4 л (1 моль) СО2
При взаимодействии 1000 г CaCO3 выделяется Х л СО2.
Отсюда объём выделяющегося углекислого газа СО2 равен 224 л.
Дата добавления: 2016-07-05; просмотров: 2892;











