Структурные формулы
В веществах атомы связаны друг с другом в определённой последовательности, а между парами атомов (между химическими связями) имеются определённые углы. Всё это необходимо для характеристики веществ, так как от этого зависят их физические и химические свойства. Сведения о геометрии связей в веществах частично (иногда полностью) отражаются в структурных формулах.
В структурных формулах связь между атомами изображается чертой. Например:
- химическая формула воды H2O, а структурная H-O-H,
- химическая формула пероксида натрия Na2O2, а структурная Na-O-O–Na,
- химическая формула азотистой кислоты HNO2, а структурная H-O-N=O.
При изображении структурных формул чёрточками обычно показывают стехиометрическую валентность элементов. Структурные формулы, построенные по стехиометрическим валентностям, иногда называются графическими.Такие структурные формулы несут информацию о составе и порядке расположения атомов, но не содержат правильных сведений о химических связях между атомами.
Например, химическая формула азотной кислоты HNO3, а структурная, построенная по стехиометрическим валентностям, изображается так:

 O
O

 H-O-N
H-O-N
O
Из этой формулы видно, что стехиометрическая валентность азота в азотной кислоте равна 5. и это правильно. Но, как показывают исследования, электронная валентность азота в азотной кислоте рана 4, так как между атомами азота и кислорода образуется не четыре, а три связи, причём, одна их них распределяется поровну между двумя атомами кислорода (такие связи называются делокализованными). Поэтому структурная формула азотной кислоты, отражающая электронную валентность элементов, такова:
Большинство оксидов, оснований и солей существуют в виде твердых соединений с ионными или частично ионными связями. Для таких соединений структурные формулы не соответствуют реальному строению веществ, а носят формальный, условный характер, показывая, как могли бы соединяться атомы, если бы вещество состояло из молекул, соответствующих формуле.
Истинную структурную формулу можно изобразить лишь на основании исследования реальной структуры вещества – экспериментально или теоретически. Эти вопросы рассматриваютя в данном пособии и в других учебных пособиях при изучениихимической связи.
При изображении структурных (графических) формул нужно выполнять следующие простые правила.
1. Число чёрточек, исходящих от каждого атома, равно его валентности.
2. В кислородсодержащих кислотах и солях со сложным кислородсодержащим катионом атомы водорода и металла соединяются с кислотообразующим элементом через атомы кислорода.
3. Атомы элементов, у которых стехиометрическая валентность в соединении совпадает с электронной валентностью, не соединяются между собой, т.е. не образуют гомоцепей.
Пример 19. Изобразить структурные формулы a) CrO3; б) Al2S3, в) K2SO4.
Решение. Определяем стехиометрические валентности атомов: V(K) = 1;
V(S) = 6; V(O) = 2. Изображаем структурную формулу, пользуясь правилами 1-3:
При изображении структурных формул солей можно исходить из соответствующих формул кислот, заменяя в них атомы водорода на атомы металла с соблюдением правила валентности, т.е. один атом водорода заменяется одновалентным металлом, два - двухвалентным, три - трехвалентным и т.д. Например, карбонат кальция (CaCO3) – это средняя соль угольной кислоты H2CO3, поэтому структурную формулу этой соли можно представить так:


 Н-О О
Н-О О


 С=О Са С=О.
С=О Са С=О.
Н-О О
Пример 20.Изобразите графические формулы кислой соли гидросульфата натрия и основной соли карбоната гидроксожелеза (III).
Решение.При составлении графических формул солей нужно отчетливо представлять себе графические формулы кислотных и основных остатков. Кислую соль (NaHSO4) можно представить как продукт замещения одного атома водорода в серной кислоте на атом натрия:
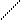

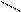


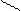 H-О O H-O O
H-О O H-O O



 S S
S S

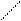 H-О O Na-O O .
H-О O Na-O O .
Основную соль (FeOHCO3) можно представить как продукт частичного замещения гидроксогрупп в основании Fe(OH)3 на кислотный остаток угольной кислоты:
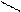
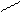 О ¾ H H-O
О ¾ H H-O
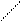 Fe ¾ O ¾ H ; C = O ;
Fe ¾ O ¾ H ; C = O ;
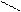 O ¾ H H-O
O ¾ H H-O
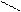
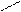 О
О

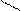 H – O – Fe C = O ;
H – O – Fe C = O ;
O
Вприведенных примерах углы между связями взяты произвольно. Однако они также могут быть точно указаны и изображены.
Эти правила не распространяются на соединения, в которых электронная и стехиометрическая валентность какого-либо элемента различны, например в пероксо- и персульфо-соединениях:
K ¾ S K ¾ O
K2S2: ½ K2O2: ½
K ¾ S K ¾ O
К такимже соединениям относятся и некоторые кислоты, в которых часть атомов водорода соединяется не с атомами кислорода, а с атомом кислотообразующего элемента непосредственно. Рассмотрим три кислоты., образуемые фофсфором: 1) форфорную, 1) фосфористую и 3) фосфорноватистую.
1. Химическая формула , структурная
2. Химическая формула , структурная
3. Химическая формула , структурная
Дата добавления: 2016-07-05; просмотров: 4836;











