Эквиваленты и эквивалентные массы
Количественный подход к изучению химических явлений и установление закона постоянства состава показали, что вещества вступают во взаимодействие в определенных соотношениях масс, что привело к введению такого важного понятия, как «эквивалент», и установлению закона эквивалентов:массы взаимодействующих без остатка веществ соотносятся как их эквивалентные массы. Математическое выражение закона эквивалентов:
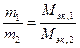 ,
,
где Мэк,1 и Мэк,2 - эквивалентные массы.
Эквивалент - это частица или часть частицы, которая соединяется (взаимодействует) с одним атомом или ионом водорода.
Из этого определения видно, что понятие «эквивалент» относится к конкретной химической реакции; если его относят к атому в химическом соединении, то имеют в виду реакцию образования этого соединения из соответствующего простого вещества и называют эквивалентом элемента в соединении.
В одном атоме, одной молекуле или формульной единице вещества (В) может содержаться Z эквивалентов этого вещества. Число Z называют эквивалентным числом (или показателем эквивалентности). Обратная величина этого числа называется фактором эквивалентности. Фактор эквивалентности (f) - доля частицы, составляющая эквивалент.
Относительная масса эквивалента называется эквивалентной массой, а масса одного моля эквивалентов, выраженная в граммах, называется молярной эквивалентной массой; она обозначается Мэк, единица измерения – моль эк/г, она численно равна относительной молекулярной массе эквивалента.
Пример 5. Определить эквивалент, эквивалентную массу и молярную массу эквивалента кислорода в молекуле воды.
Решение. Такая формулировка вопроса предполагает реакцию образования воды из кислорода и водорода H2 + ½O2 = Н2О, в которой с 1 атомом водорода соединяется ½ атомов кислорода. Следовательно, Z(О) = 2. Атомная масса кислорода равна 16. Эквивалентом кислорода является ½ его атома, эквивалентная масса равна 8, а молярная масса эквивалента равна 8 г/ моль.
Эквиваленты одних и тех же элементов в различных химических соединениях могут различаться, т.к. величина эквивалента зависит от характера превращения, претерпеваемого им. Так, в соединении SO2 эквивалентная масса серы равна 8 г/моль, что составляет 1/4 от атомной массы, а в соединении SO3 - 5,3 г/моль, что составляет 1/6 от атомной массы серы. Эквивалентное число серы в этих оксидах равно 4 и 6, т.е. оно равно степени окисления (стехиометрической валентности) серы в этих соединениях. Таким образом, относительная эквивалентная масса и численно равная ей молярная масса элемента в соединении вычисляется по формуле:
Мэк (элемента)= 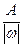 , (1.7)
, (1.7)
где А - атомная масса, w - степень окисления элемента в данном соединении.
Например, Z(Mn) в соединении KMnO4 составляет 7(w = +7), а Мэк (Mn) =  = 7,85 г/моль; в соединении Mn2O3 Z = 3 и поэтому Мэк (Mn) =
= 7,85 г/моль; в соединении Mn2O3 Z = 3 и поэтому Мэк (Mn) = 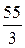 = 18,3 г/моль.
= 18,3 г/моль.
Эквивалентная масса вещества имеет различные значения в зависимости от того, в какой химической реакции участвует это вещество. При расчете эквивалентных масс можно пользоваться следующими правилами и формулами.
1. Эквивалентная масса кислоты в реакциях замещения ионов водорода равна:
Мэк кислоты = 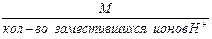
2. Эквивалентная масса основания в реакции замещения гидроксид-ионов равна:
Мэк основания = 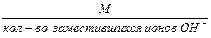
Пример 6. Определить эквивалентную массу H2SO4 в реакциях:
1) H2SO4 + KOH = KHSO4 + H2O
2) H2SO4 + 2KOH = K2SO4 + 2H2O
Решение.В реакции 1 замещён один ион водорода, следовательно, эквивалентное число серной кислоты Z(H2SO4) = 1, Мэк(H2SO4) = 98 г/моль эк. В реакции 2 заместились оба иона водорода, следовательно, эквивалентное число Z(H2SO4) = 2, а Mэк(H2SO4) = 49 г/моль эк.
Пример 7. Определить эквивалентную массу гидроксида висмута в реакциях:
1) Bi(OH)3 + HCl = Bi(OH)2Cl + H2O
2) Bi(OH)3 + 3HCl = BiCl3 + H2O
Решение.1)Z(Bi(OH)3) = 1, а Mэк(Bi(OH)3) = 260 г/моль эк, т.к. из трех гидроксид-ионов заместился один; 2) Z(Bi(OH)3) = 3, a Mэк(Bi(OH)3) = 260:3 = 86,3 г/моль эк, т.к. заместились все три иона ОН-).
3. Эквивалентная масса соли в реакциях полного замещения катиона или аниона равна:
Мэк. соли = 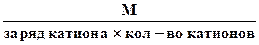
или Мэк соли = 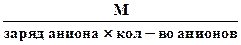
Например. в сульфате алюминия Al2(SO4)3 произведение заряда катиона на их число равно 3×2 = 6. Но эквивалентное число соединения в реакции может быть меньше (неполное замещение катионов) или больше (комплексообразование). Если, например, это соединение участвует во взаимодействии
Al2(SO4)3 + 12KOH = 2K3[Al(OH)6] + 3K2SO4,
то при этом три сульфат-аниона с суммарным зарядом 6 замещаются двенадцатью гидроксид-ионами ОН-, следовательно, в этой реакции Z(Al2(SO4)3) = 12.
4. Эквивалентная масса оксида в реакциях полного замещения равна
Мэк оксида = 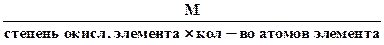
Например, Z(Fe2O3) = 3×2 = 6, Мэк = М(Fe2O3) = 160:6 = 26,6 г/моль эк. Но в реакции
Fe2O3 + 4HCl = 2FeOHCl2 + H2O
Z(Fe2O3) = 4, Мэк(Fe2O3) = 160:4 = 40 г/моль эк, т.к. одна формульная единица Fe2O3 взаимодействует с четырьмя эквивалентами HCl.
При решении задач, связанных с газообразными веществами, целесообразно пользоваться значением эквивалентного объема. Это объем, занимаемый одним молем эквивалентов газообразного вещества. Для водорода при н.у. этот объем равен 11,2 л/моль эк (так как Мэк(Н) = 1 г/моль эк), а для кислорода – 5,6 л/моль эк (так как Мэк(О) = 8 г/моль эк).
Пример 8. На восстановление 1,80 г оксида металла израсходовано 883 мл водорода (н.у.). Вычислить эквивалентные массы оксида и металла.
Решение. Согласно закону эквивалентов, массы (объемы) реагирующих веществ пропорциональны их эквивалентным массам (объемам):
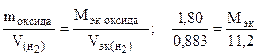
Отсюда
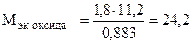 (г/моль),
(г/моль), 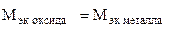 +
+ 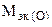 ,
,
следовательно
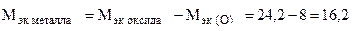 г/моль эк.
г/моль эк.
Пример 9. Вычислить эквивалентную массу цинка, если 1,168 г этого металла вытеснили из кислоты 438 мл Н2 (Т = 17 °С и Р = 750 мм рт. ст.).
Решение. 1) По уравнению Клапейрона–Менделеева вычисляем массу водорода:
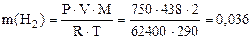 г
г
Согласно закону эквивалентов
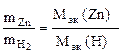 ,
,
следовательно
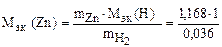 = 32,6 г/моль эк.
= 32,6 г/моль эк.
Дата добавления: 2016-07-05; просмотров: 16969;











