Молекулярность реакции
Наименьшее число частиц в элементарном акте химического превращения определяет молекулярность реакции.
Если реакция aA + bB  cC + +dD протекает в одну стадию, т.е. является элементарной, то молекулярность ее равна величине а+в, т.е. сумме стехиометрических коэффициентов исходных веществ. Молекулярность всегда – целое число. Существуют моно-, би- и редко тримолекулярные реакции. Вероятность столкновений четырех и более частиц невелика.
cC + +dD протекает в одну стадию, т.е. является элементарной, то молекулярность ее равна величине а+в, т.е. сумме стехиометрических коэффициентов исходных веществ. Молекулярность всегда – целое число. Существуют моно-, би- и редко тримолекулярные реакции. Вероятность столкновений четырех и более частиц невелика.
К мономолекулярным реакциям относятся некоторые реакции разложения молекул, реакции внутримолекулярных перегруппировок, реакции радиактивного распада.
J2 → 2J
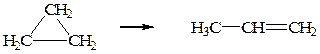
К бимолекулярным реакциям относятся такие, в которых взаимодействие происходит при столкновении двух молекул различного или одинакового вида:
НJ → H2 + J2
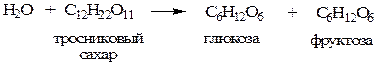
К тримолекулярным относятся реакции, в которых необходимо столкновение трех молекул:
2 NO + H2 → N2O + H2O
Если же реакция происходит через несколько элементарных актов, то каждый акт имеет свою молекулярность. Например, в реакции
Н2(г) + Br2(г) → 2 HBr(г) (а)
Происходят следующие стадии:
1. Br2(г) → 2 Br (мономолекулярная стадия)
2. Br +Н2→ HBr(г) + Н (бимолекулярная стадия)
3. Н + Br2(г) → HBr(г) + Br (бимолекулярная стадия)
По виду стехиометрического уравнения (а) нельзя судить о молекулярности, надо знать механизм течения реакции, а значит классифицировать по молекулярности можно лишь реакции, протекающие в одну стадию. Поэтому для характеристики кинетики экспериментально изучаемых реакций вводится более формальный признак – порядок реакции.
Порядок реакции
Порядок реакции по данному веществу – число, равное степени, в которой концентрация этого вещества входит в кинетическое уравнение реакции:

где m – частный порядок по веществу А; n - частный порядок по веществу В.
Сумма показателей степеней, в которых концентрации всех исходных веществ входят в кинетическое уравнение, определяет порядок реакции.
Если реакция проходит в одну стадию, то молекулярность совпадает с ее порядком. Обычно же порядок не совпадает с молекулярностью. Это происходит потому, что реакции, как правило, не протекают пуием непосредственного взаимодействия одновременно всех исходных частиц с прямым переходом их в продукты реакции. Это прежде всего относится к тем реакциям, в которых принимает участие более трех частиц.
Однако, даже реакции, в которых участвуют две или одна молекулы, часто идут не по бимолекулярному или мономолекулярному механизму, а более сложным путем. В простейшем случае, когда одна из стадий протекает очень медленно по сравнению с остальными, скорость (и порядок) реакции определяется этой наиболее медленной реакцией, которая называется лимитирующей. Если же скорости реакций отдельных стадий сравнимы, а эти стадии являются к тому же сложными, то картина еще более усложняется. В общем случае коэффициенты в стехиометрическом уравнении аА + вВ  сС + Дд и показатели степеней концентраций в кинетическом уравнении
сС + Дд и показатели степеней концентраций в кинетическом уравнении

будут различны, а порядок реакции равен сумме показателей в кинетическом уравнении п = m + n.
Реакции могут быть первого, второго, третьего, дробного и нулевого порядков. Так, рассмотренная нами выше реакция
Н2(г) + Br2(г) → 2 HBr(г)
является реакцией полуторного порядка, так как стадия (1) – реакцией первого порядка, стадия (2) и (3) – второго порядка, причем стадия (3) является сложной (обратимой). В целом реакция имеет полуторный порядок.
Реакциями нулевого порядка называют реакции, в которых скорость процесса сохраняется постоянной во времени. Это встречается в некоторых гетерогенных системах. Так, если в реакции омыления сложного эфира с водой в разбавленном водном растворе
СН3СООС2Н5 + Н2О → СН3СООН + С2Н5ОН
применять эфир, малорастворимый в воде, и взять его в избытке, чтобы в системе присутствовал эфирный слой, то расход эфира будет постоянно восполняться из эфирного слоя. Таким образом, концентрация его в водном растворе будет постоянной. Но так как реакция идет в разбавленном водном растворе, т.е. в присутствии избытка воды, то концентрация воды изменяется весьма незначительно, ее можно считать тоже постянной, следовательно, постоянной будет скорость процесса. И реакция в целом имеет нулевой порядок. Если же только один из компонентов, например, вода, в избытке, то расход ее в реакции практически не отражается на ее концентрации (порядок по воде равен нулю) и скорость реакции зависит лишь от изменения концентрации эфира. Порядок реакции в этом случае равен порядку по эфиру.
Дата добавления: 2016-06-22; просмотров: 4233;











