Потенциометрическое титрование
Под потенциометрическим титрованием понимают метод определения эквивалентной точки на основе зависимости потенциала от объема добавленного титранта в исследуемую систему. По сравнению с индикаторным титрованием этот метод дает большую точность, позволяет производить титрование окрашенных растворов и смеси веществ.
Для проведения потенциометрического титрования составляется электрохимическая цепь, состоящая из двух электродов: электрода сравнения и индикаторного электрода. Электрод сравнения должен иметь в процессе титрования постоянное значение потенциала, точно известное и легко воспроизводимое.
Таблица - Электроды сравнения
| Электрод сравнения | 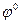 , В , В
|
| H+ | H2, Pt | |
| Cl- | Hg2Cl2, Hg | 0,268 |
| Cl- | AgCl, Ag | 0,222 |
| SO42- | HgSO4, Hg | -,359 |
| OH- | HgO, Hg | 0,098 |
Тип индикаторного электрода выбирается в зависимости от определяемых ионов. Индикаторный электрод должен быть обратимым относительно определяемого иона, тогда потенциал его будет чувствителен к изменению концентрации титруемого раствора.
При титровании используются реакции нейтрализации, осаждения, комплексообразования, окислительно – восстановительные. Рассмотрим некоторые из них.
Реакции нейтрализации используются для определения концентрации ионов Н+ или ОН-. Суть реакции нейтрализации состоит в уменьшении ионов Н+ (при титровании кислоты) или ОН- (при титровании щелочи):
Н+ + ОН- → Н2О
В качестве индикаторного электрода следует брать электрод, обратимый относительно ионов Н+ (водородный):
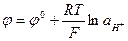
При титровании кислоты 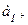 будет уменьшаться, следовательно
будет уменьшаться, следовательно 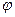 тоже будет уменьшаться. Вблизи точки эквивалентности это уменьшение происходит особенно резко.
тоже будет уменьшаться. Вблизи точки эквивалентности это уменьшение происходит особенно резко.
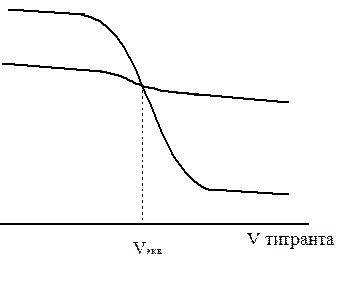
Рисунок - кривые титрования сильной кислоты: а) для концентрированных растворов кислоты и основания; б) для разбавленных растворов – скачок слабый.
При титровании щелочи уменьшается 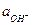 которая связана ионным произведением воды с
которая связана ионным произведением воды с 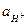 :
:
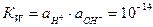 (при 298 К)
(при 298 К)
Таким образом, уменьшение 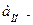 приводит к росту
приводит к росту 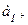 и потенциал водородного электрода будет увеличиваться, давая резкий скачок в точке эквивалентности.
и потенциал водородного электрода будет увеличиваться, давая резкий скачок в точке эквивалентности.
Реакции окисления – восстановления. При окислительно – восстановительном титровании берется в качестве индикаторного электрода редокс – электрод, потенциал которого изменяется по мере добавления титранта. Например, при титровании ионов Sn2+ раствором KMnO4 идет реакция:
5Sn2+ + 2MnO4- + 16H+ → 5 Sn4+ + 2Mn2+ + 8H2O
До точки эквивалентности потенциал определяется исходной системой, т.е. электродом Sn4+, Sn2+ l Pt
Sn4+ + 2e → Sn2+ 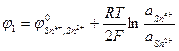
Когда 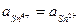 (оттитрована половина исходного количества Sn2+)
(оттитрована половина исходного количества Sn2+) 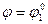 по мере титрования появляются ионы Mn2+, а ионы MnO4- исчезают. После точки эквивалентности ионов Sn2+ нет, но появляются ионы MnO4-, т.е. образуется новый редокс – электрод, MnO4-, Mn2+, H+ l Pt
по мере титрования появляются ионы Mn2+, а ионы MnO4- исчезают. После точки эквивалентности ионов Sn2+ нет, но появляются ионы MnO4-, т.е. образуется новый редокс – электрод, MnO4-, Mn2+, H+ l Pt
MnO4- + 8H+ + 5e → Mn2+ + 4H2O 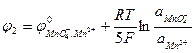
Когда 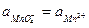 (после точки эквивалентности добавлен избыток KMnO4 в количестве, равном объему, израсходованному до точки эквивалентности),
(после точки эквивалентности добавлен избыток KMnO4 в количестве, равном объему, израсходованному до точки эквивалентности), 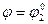 .
.
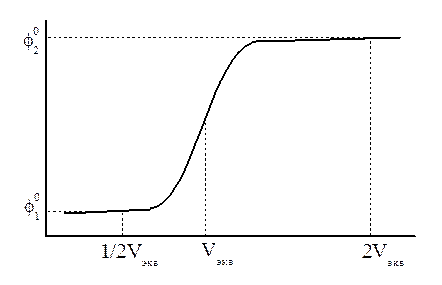
Рисунок - Кривая окислительно – восстановительного титрования
Электролиз
Электролиз – это процессы, протекающие на электродах при пропускании электрического тока через растворы или расплавы электролитов.
Фарадеем установлены количественные законы электролиза.
Первый закон: количество прореагировавшего при электролизе вещества пропорционально количеству прошедшего через раствор электричества:
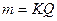
где m – масса вещества; Q - количество электричества; К – электрохимический эквивалент.
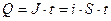 ;
; 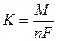
где i- плотность тока; S – площадь; t – время, с; М – молярная масса; F – число Фарадея, 96485 Кл; n – число электронов участвующих в электродной реакции.
Второй закон: при определенном количестве прошедшего электричества отношение масс прореагировавших веществ равно отношению их химических эквивалентов, Э:
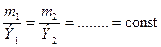
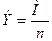
Задача 1
Вычислить ЭДС элемента, составленного из хлорсеребряного электрода в растворе НСl (С = 0,01 моль/л), с учетом диффузионного потенциала при 25 0С.
Дано:
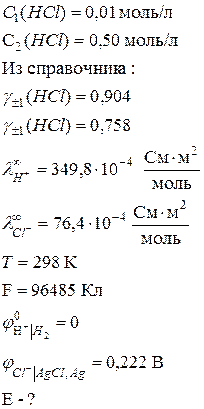
Решение:
Составляем гальваническую цепь из газового электрода, и электрода второго рода. Определяем знаки электродов из сравнения значений 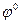 . Записываем реакции на электродах согласно их знакам:
. Записываем реакции на электродах согласно их знакам:
(-) Pt, H2 | HCl || HCl | AgCl, AgCl (+)

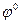 = 0
= 0 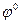 = 0,222 В
= 0,222 В
С2 = 0,50 С1= 0,01
Н2 – 2е → 2Н+ 2AgCl + 2e → 2Ag+ + 2Cl-
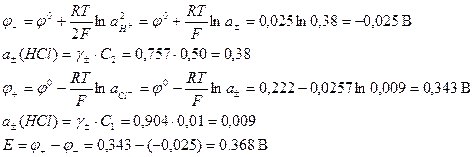
Это значение ЭДС без учета диффузионного потенциала.
В данном случае 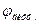 возникает на границе двух растворов электролитов одинаковых по химической природе, но с различными концентрациями.
возникает на границе двух растворов электролитов одинаковых по химической природе, но с различными концентрациями.
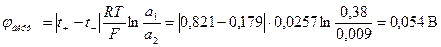
Полученная величина - значение 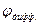 по модулю.
по модулю.
Для определения знака 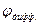 рассмотрим направление электрического поля на границе растворов (см. гальваническую цепь). Поскольку С2 > С1, диффузия HCl будет идти слева направо, при этом ионы Н+, имеющие большую подвижность,
рассмотрим направление электрического поля на границе растворов (см. гальваническую цепь). Поскольку С2 > С1, диффузия HCl будет идти слева направо, при этом ионы Н+, имеющие большую подвижность, 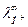 , будут опережать ионы, Сl-, образуя двойной электрический слой (ДЭС) на границе растворов с положительной правой обкладкой (см. цепь) и отрицательной левой. Таким образом, направление поля ДЭС и направление поля электродов совпадает и
, будут опережать ионы, Сl-, образуя двойной электрический слой (ДЭС) на границе растворов с положительной правой обкладкой (см. цепь) и отрицательной левой. Таким образом, направление поля ДЭС и направление поля электродов совпадает и 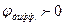 .
.
Задача 2.
Рассчитать диффузионный потенциал гальванической цепи и определить его знак.
(-) Hg, Hg2Cl2 | KCl CuSO4 | Cu (+)
если СКСl = 0,01, CCuSO4 = 0,01 моль/л.
Справочные данные:
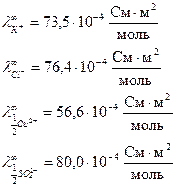
Решение:
Поскольку граничащие растворы различаются по химической природе, а их концентрации одинаковы, то расчет  производится по формуле:
производится по формуле:
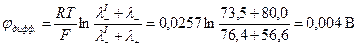
Определим знак 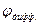 .
.
Так как концентрация обоих электролитов одинакова, то диффузия ионов будет происходить и слева направо и справа налево. Движение К+ и Сu2+ происходит в противоположных направлениях, но у К+ подвижность больше на 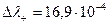 и с правой стороны границы накапливается положительный заряд. При движении Сl- и SO42-
и с правой стороны границы накапливается положительный заряд. При движении Сl- и SO42- 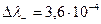 , то есть за счет большей подвижности SO42-, слева накапливается отрицательный заряд, но
, то есть за счет большей подвижности SO42-, слева накапливается отрицательный заряд, но 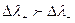 , что дает в итоге положительный потенциал справа, . Направление полей ДЭС и электродов совпадает,
, что дает в итоге положительный потенциал справа, . Направление полей ДЭС и электродов совпадает, 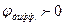 .
.
Задача 3.
При электролизе раствора, содержащего Pb2+ , через 70 минут на поверхности 1,2 дм2 получено покрытие толщиной 108 мкм при плотности тока 3,0 А/дм2. При этом выделилось некоторое количество водорода. Рассчитать выход по току для свинца и объем выделившегося водорода при н.у., 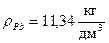 .
.
Дано:
t = 70 мин = 4200 с
S = 1,2 дм2
h = 108 мкм = 108·10-5 дм
i = 3,0 А/дм2
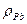 = 11,34 кг/дм3
= 11,34 кг/дм3
ВТ (Pb)-?
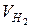 - ?
- ?
Решение
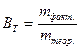
По I закону Фарадея: 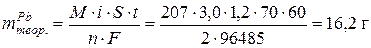
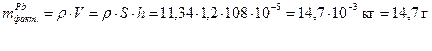
Фактическая масса свинца меньше теоретической за счет того, что часть количества электричества расходуется на восстановление водорода. Недополученное количество свинца равно 16,2 – 14,7 = 1,5 г. Вместо него выделился водород, масса которого может быть рассчитана по второму закону Фарадея: 
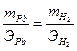 ;
;
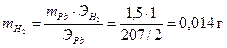
Объем водорода при нормальных условиях (Р = 1 атм., Т = 273 К) определяется по уравнению идеального газового состояния:
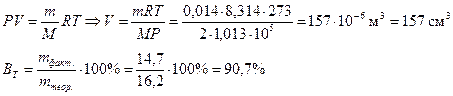
Кинетика
Химическая кинетика – учение о химическом процессе, закономерностях протекания его во времени, его механизме. Она открывает возможность сознательного управления промышленными процессами, позволяет ставить и решать вопросы интенсификации существующих и создания новых технологических процессов.
Задачи кинетики и термодинамики различны. Термодинамика ставит и решает задачи определения состояния равновесия, константы равновесия, выхода продуктов, но не может определить время достижения равновесия, скорость процесса, концентрации веществ в любой момент времени. Эти задачи решает химическая кинетика. Но химическая кинетика может увеличить скорость реакции только той, которая является термодинамически возможной. Ниже приведены реакции получения из простых веществ водородных соединений неметаллов.
| ΔG0, кДж/моль | ||
| H2 + | Cl2 → HCl | -93,8 |
| O2 → H2O | -225,0 | |
| N2→ NH3 | -16,4 | |
| P → PH3 | 13,2 | |
| C → CH4 | -50,0 |
Термодинамический анализ показывает, что все реакции (кроме четвертой, где 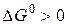 ) возможны. Но, например, реакция 3 имеет при обычных условиях очень низкую скорость и аммиак практически не образуется. И здесь уже задача кинетики – превратить возможность в действительность, что на практике достигается повышением температуры до 500 0С и применением катализатора.
) возможны. Но, например, реакция 3 имеет при обычных условиях очень низкую скорость и аммиак практически не образуется. И здесь уже задача кинетики – превратить возможность в действительность, что на практике достигается повышением температуры до 500 0С и применением катализатора.
Если реакция протекает в одной фазе (газообразной или жидкой), то их изучением занимается кинетика гомогенных процессов. Если реакции совершаются на поверхности раздела фаз, то изучение их скоростей относится к кинетике гетерогенных процессов.
Дата добавления: 2016-06-22; просмотров: 3474;











