Метод по доле непревращенного вещества к моменту времени t
Если 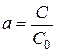 - доля исходного вещества, не вступившая в химическую реакцию к моменту времени t, то
- доля исходного вещества, не вступившая в химическую реакцию к моменту времени t, то 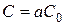 . Подставляя выражение для «С» в уравнение
. Подставляя выражение для «С» в уравнение
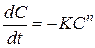
получаем:
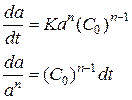
Интегрирование в пределах (а=1; а) и (t=0; t) приводит к уравнению:


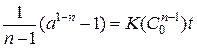
Уравнение сложно для расчета «n», поэтому его применяют в двух частных случаях:
а) проводят ряд опытов, в которых взяты разные начальные концентрации, но во всех опытах реакция доведена до одинаковой доли «а». В таких условиях левая часть уравнения ( ) постоянна, обозначим ее «В»:
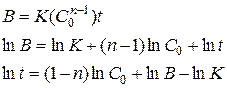
Полученное уравнение прямой в координатах (lnt; lnC0) позволяет графически найти «n», поскольку 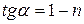 . Если проведено два опыта с одинаковым значением «а», то, записав уравнение ( ) для обоих опытов и вычитая одно из другого, получаем уравнение для «n»:
. Если проведено два опыта с одинаковым значением «а», то, записав уравнение ( ) для обоих опытов и вычитая одно из другого, получаем уравнение для «n»:
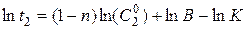
-

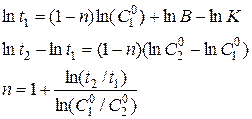
б) Можно определить порядок, располагая одной полной кинетической кривой. Выбирают на кривой два значения «а», связанные между собой соотношением:
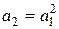
При этом скобка в левой части уравнения ( ) для а2 будет иметь вид:
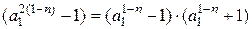 ( )
( )
Записав уравнение ( ) для второго опыта и для первого и поделив уравнения одно на другое получаем, сократив общие множители:
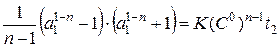
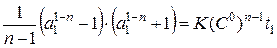
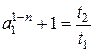
После логарифмирования получаем:
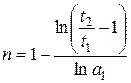
Задачи
Задача 1.
Время половинного разложения уксусно-этилового эфира (С0 = 0,025 моль/л) щелочью (С0 = 0,050 моль/л) равно 6,81 мин. Определить время разложения эфира на 80 %. Реакция второго порядка.
Дано:
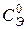 = 0,025 моль/л
= 0,025 моль/л
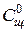 = 0,050 моль/л
= 0,050 моль/л
t1/2 = 681 мин
β = 0,8
n = 2
Решение:
СН3СООС2Н5 + NaOH → СН3СООNa + С2Н5OH
t = 0 0,025 0,050
t1/2=6,81 0,025-0,025∙1/2 0,050-0,025∙1/2
t = ? 0,025-0,025∙0,8 0,050-0,025∙0,8
При расчете текущей концентрации следует учесть, что по уравнению реакции реагируют в соотношении 1 : 1, поэтому в любой момент времени количество прореагировавших эфира и щелочи одинаково. Можно рассчитать константу равновесия из данных второй строчки, то есть через 6,81 минут от начала реакции.
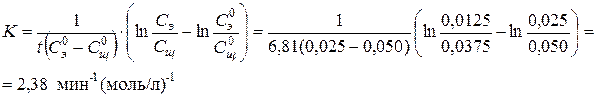 По рассчитанному значению константы, из этого же уравнения находится время, в течение которого прореагирует 80 % эфира, то есть
По рассчитанному значению константы, из этого же уравнения находится время, в течение которого прореагирует 80 % эфира, то есть 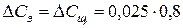 (данные третьей строки).
(данные третьей строки).
Задача 2.
При 310 0С AsH3 (газ) разлагается с образованием твердого мышьяка и водорода. Во время реакции давление в системе изменяется следующим образом:
| t, час | 2,5 | 5,5 | 6,5 | 8,0 | |
| Р, мм.рт.ст. |
Показать, что реакция является реакцией первого порядка и вычислить константу скорости.
Решение:
Для подтверждения первого порядка используем графический метод, по которому зависимость lnP от t должна быть линейной. Под логарифмом стоит текущее давление исходного компонента AsH3. В то же время в таблице дано давление в системе, то есть общее давление, состоящее из исходного AsH3 и образующегося Н2, поэтому следует из общего давления выделить давление AsH3.
2AsH3 → 2As + 3 Н2
газ тв газ
t=0 P0 0
t P0-x 3/2x
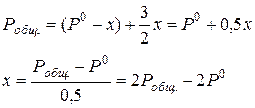
Отсюда текущее давление AsH3:
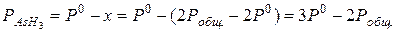
Р0 =733 мм.рт.ст. при t = 0.
Данные текущего давления заносим в таблицу, строим график lnP = f (t).
| t, час | 2,5 | 5,5 | 6,5 | 8,0 | |
| РAsH3, м.рт.ст. | |||||
| lnРAsH3 | 6,597 | 6,500 | 6,357 | 6,333 | 6,271 |
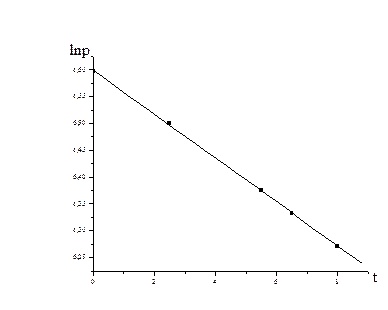
Константу скорости можно найти из графика, поскольку 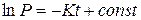 .
. 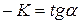 .
.
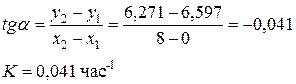
Задача 3.
Определить порядок реакции: 2СО → СО2 + С, если при постоянной температуре в одном опыте начальное давление СО упало с 787 до 688 мм.рт.ст. за 10 минут, а вдругом с 535 до 468 мм.рт.ст. за это же время.
Дано:
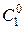 =787 мм.рт.ст.
=787 мм.рт.ст.
С1=688 мм.рт.ст.
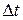 = 10 мин
= 10 мин
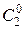 =535 мм.рт.ст.
=535 мм.рт.ст.
С2 = 468 мм.рт.ст.
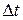 = 10 мин
= 10 мин
n = ?
Решение:
В данном случае порядок можно определить методом начальных скоростей:
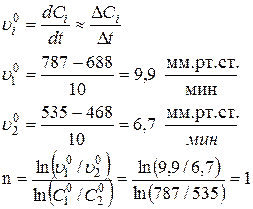
Задача 4.
При изучении реакции 2NO + 2H2 → N2 + 2H2O при начальных давлениях NO и H2 равных 4,72∙104 Па в первом опыте и 2,69∙104 Па во втором половина вещества прореагировала за 81 с и 239 с соответственно. Определить порядок реакции.
Дано:
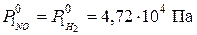
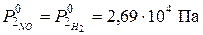
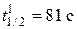
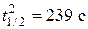
а1 = а2 = ½
n = ?
Решение:
Поскольку в обоих опытах доля непрореагировавшего вещества одинакова, то порядок определим по уравнению:
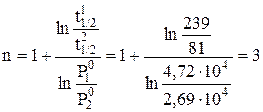
В данном случае получен общий порядок реакции, так как исходные давления взяты в стехиометрическом соотношении.
Дата добавления: 2016-06-22; просмотров: 3113;











