Реакции первого порядка

Пусть реакция является кинетически не обратимой реакцией первого порядка.
Составим дифференциальное уравнение которым описывается изменение концентрации исходного вещества А:
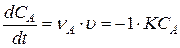
Поскольку А – единственное исходное вещество впредь будем опускать индекс «А».
Решаем дифференциальное уравнение :
 ( )
( )
Уравнение ( ) является уравнением прямой в координатах (lnC; t), рисунок .
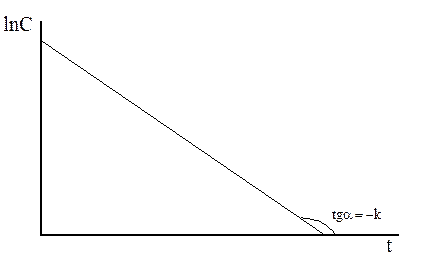
Рисунок
Константа скорости может быть найдена как тангенс наклона прямой.
Определенное интегрирование дает:

т.е. константа не зависит от способа выражения концентрации. Если известна константа скорости «К», то можно определить текущую концентрацию:
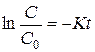
Отсюда 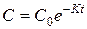 - уравнение текущей концентрации.
- уравнение текущей концентрации.
Существенное значение имеет время, за которое концентрация исходного вещества упадет в два раза, так называемое время полураспада (t1/2) или полупериод реакции.
 ( )
( )
Таким образом, из уравнения ( ) видно, что полупериод реакции первого порядка не зависит от начальной концентрации.
Скорость, разумеется, будет зависеть от концентрации (рисунок ).

Рисунок – Кинетические кривые реакции первого порядка для различных начальных концентраций.
Как видно из рисунка время, за которое начальная концентрация упадет вдвое, сохраняется постоянным для данной реакции, а скорость падает (кривые становятся более пологими с уменьшением начальной концентрации).
Дата добавления: 2016-06-22; просмотров: 2991;











