Методы определения порядка реакции
Для определения порядка реакции в целом необходимо определить частные порядки по каждому веществу, вступающему в реакцию, а затем суммировать их. Для определения порядка по данному веществу необходимо создать условия, при которых будет изменяться концентрация только этого вещества.
Укажем некоторые из таких условий:
1. В реакции принимает участие одно исходное вещество.
2. Скорость реакции зависит от концентрации одного реагента и катализатора, а концентрация катализатора постоянна по ходу реакции.
3. Все реагенты, кроме одного, берутся в большом избытке, в результате чего их концентрации мало меняются по ходу реакции и могут рассматриваться как постоянные.
4. Концентрация всех реагентов, кроме одного, поддерживается постоянной каким-либо искусственным путем. Например, проводя реакции с участием иона ОН- как реагента, можно обеспечить присутствие буфера для поддержания концентрации ОН-.
При определении порядка реакции используется основное свойство кинетического уравнения 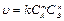 , согласно которому константа скорости и порядка реакции по ее компонентам остаются постоянными в течение всей реакции, а так же при изменении начальных концентраций реагентов.
, согласно которому константа скорости и порядка реакции по ее компонентам остаются постоянными в течение всей реакции, а так же при изменении начальных концентраций реагентов.
Метод подстановки
По ходу реакции определяют текущие концентрации исходного вещества в различные моменты времени от начала реакции.
Предполагают, что реакция первого порядка. По уравнению для константы скорости первого порядка (стр. ) рассчитывают все возможные значения «К». Если значения «К» постоянны (в пределах ошибки опыта), то реакция имеет первый порядок. Если же не постоянны значения «К», или закономерно убывают или возрастают, то реакция не первого порядка. Аналогично проверяют на второй порядок. Если реакция не первого и не второго порядка, то для определения порядка используют другие методы.
Графический метод
Этот метод основан на том, что кинетическая кривая может иметь линейный вид f (x) – t, где вид f (x) соответствует конкретному порядку реакции:
для 1го порядка ln C = f (t)
для 2го порядка 1/С = f (t)
для 3го порядка 1/С2 = f (t)
для нулевого порядка Спродукта = f (t)
Поочередно строя такие зависимости, смотрят, в каких координатах получается прямая линия.
Этот метод и метод подстановки взаимосвязаны, и нет смысла его использовать, если метод подстановки не выявил порядок реакции.
3 Метод начальных скоростей
Скорость расходования вещества в начальный момент времени:
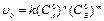
Для понижения порядка проводят ряд опытов, в которых берется вещество А с различной начальной концентрацией,  , а начальная концентрация B во всех опытах берется одинаковой. Тогда
, а начальная концентрация B во всех опытах берется одинаковой. Тогда 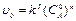 , где
, где 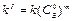 .
.
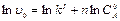
Получилось уравнение прямой в координатах ( 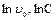 ) с тангенсом угла наклона, равным порядку реакции, n. Для определения начальных скоростей получают начальные участки кинетических кривых, поскольку лишь в начале реакции сохраняется постоянство концентрации вещества В.
) с тангенсом угла наклона, равным порядку реакции, n. Для определения начальных скоростей получают начальные участки кинетических кривых, поскольку лишь в начале реакции сохраняется постоянство концентрации вещества В.
Порядок реакции можно приблизительно определить по значениям двух начальных скоростей ( 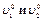 ), которые соответствуют двум начальным концентрациям реагента (
), которые соответствуют двум начальным концентрациям реагента ( 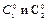 ), используя соотношение ( ):
), используя соотношение ( ):
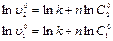
Вычитая второе уравнение из первого, получаем 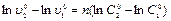 откуда получаем:
откуда получаем: 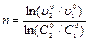 .
.
Для приближенного расчета скоростей можно использовать соотношение: 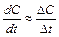 ,
,
где 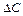 - изменение концентрации реагента за промежуток времени
- изменение концентрации реагента за промежуток времени 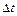 .
.
Дата добавления: 2016-06-22; просмотров: 4437;











