Разность потенциалов на концах равновесной электрохимической цепи называется электродвижущей силой (эдс) и обозначается Е.
Электрохимическую цепь можно представить схематически. Например:
Cu | Zn | ZnS04 | CuS04 | Cu
Вертикальной сплошной чертой показывается наличие скачка потенциала на границе металл-металл, металл-раствор, а пунктирной - на границе двух растворов, так называемый диффузионный потенциал. Часто при записи цепи опускается повторение металла, предполагая, что цепь является правильно разомкнутой.
Разность потенциалов Е на концах этой цепи складывается из четырех гальвани-потенциалов, каждый из которых отдельно замерен быть не может:
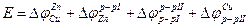
Полезная работа обратимого процесса (в данном случае электрическая) равна убыли энергии Гиббса, т.е. 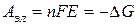
Для реакций, самопроизвольно протекающих в гальваническом элементе (∆G>0), эдс - положительна. Этому соответствует запись гальванического элемента так, чтобы правый электрод был более электроположителен, чем левый, движение электронов при этом происходит от левого электрода к правому, на котором и идет реакция восстановления.
На положительном электроде идет реакция восстановления, на отрицательном - окисления.
Эдс гальванического элемента можно рассчитывать по формуле Нернста:
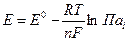 (1)
(1)
где Е0- стандартная эдс цепи при активностях всех компонентов, равных единице; n - число электронов, участвующих в реакции; 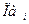 - произведение активностей всех участников окислительно-восстановительной реакции в гальваническом элементе с учетом стехиометрических коэффициентов, которые для исходных веществ берутся со знаком «минус», а для продуктов «плюс».
- произведение активностей всех участников окислительно-восстановительной реакции в гальваническом элементе с учетом стехиометрических коэффициентов, которые для исходных веществ берутся со знаком «минус», а для продуктов «плюс».
Так, для приведенной выше гальванической цепи, где протекает реакция
CuS04 + Zn →ZnS04 + Сu,
ЭДС можно рассчитать по уравнению (1):
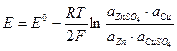
Комбинируя различные электроды между собой, можно получить множество электрохимических цепей. Поскольку измерить гальвани-потенциал невозможно, то за величину, характеризующую процесс на отдельном электроде, принимают электродный потенциал.
Дата добавления: 2016-06-22; просмотров: 2346;











