Классификация электродов
В зависимости от природы веществ, участвующих в электродной реакции, электроды делятся на две группы:
1. Электроды, образованные электрохимически активными металлами, участвующими в токообразующей реакции.
2. Электроды с инертными металлами, не участвующими в токообразующей реакции.
К первой группе относятся электроды первого и второго рода.
Электроды первого рода - системы, состоящие из металла, опущенного в раствор соли этого металла. Например: Ag+ | Ag; Sn2+ | Sn. Реакции на электродах:
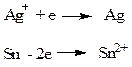
Потенциал рассчитывается по уравнению (2)
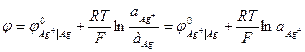 , так как активность чистого твердого вещества равна единице.
, так как активность чистого твердого вещества равна единице.
К электродам первого рода относятся амальгамные электроды, сплавы, в которых меняется активность металла. Амальгама – металлическая система, одним компонентом которой является ртуть. Это, в основном твердые растворы, химические соединения, жидкие растворы.
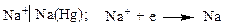
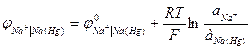
Здесь электродный потенциал зависит также и от активности металла в амальгаме.
Электроды второго рода.К ним относят металлические электроды, покрытые труднорастворимым соединением этого металла (солью, гидроксидом или оксидом), погруженные в раствор, содержащий анионы этой соли или ионы ОН- или Н+ в случае гидроксида или оксида. Восстановление металла в этом случае идет из соли, оксида или гидроксида. При записи электрода вещества, из которых состоит электрод, записываются через запятую. Раствор отделяется вертикальной чертой, показывающей наличие скачка потенциала.
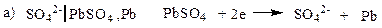
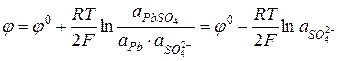
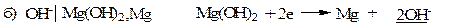
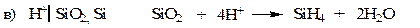
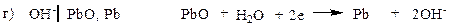
В случае оксидно – металлических электродов (б, в, г) электродный потенциал зависит от рН раствора.
Ко второй группе относятся газовые и окислительно – восстановительные электроды.
Газовые электроды состоят из инертного металла (часто платины) к которому подводится электрохимически активный газ. Молекулы газа адсорбируются на поверхности металла, распадаясь на атомы, которые и участвуют в электродном процессе. Платина с адсорбированным газом частично погружена в раствор, содержащий ионы этого газа. Примерами таких электродов могут служить водородный, хлорный, кислородный.
Водородный электрод в кислой среде.
Н+I H2, Pt Н+ + е → 1/2Н2
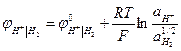
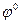 = 0 при аН+ = 1 рН = 0.
= 0 при аН+ = 1 рН = 0.
В щелочной среде:
ОН- I H2, Pt 2Н2О + 2е → Н2 + 2 ОН-
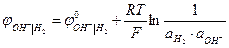
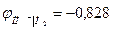 В при аОН- = 1 при рН = 14.
В при аОН- = 1 при рН = 14.
Кислородный электрод в отличие от водородного электрода является необратимым.
В кислом растворе
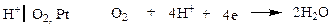
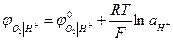 (при РО2 = 1)
(при РО2 = 1)
При аН+ = 1 рН = 0 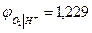 В
В
В нейтральном или щелочном растворе
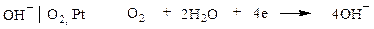
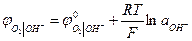
При аОН- = 1 рН = 14 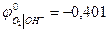 В
В
Уравнения для 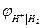 и
и 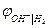 термодинамически идентичны. Идентичны и уравнения для
термодинамически идентичны. Идентичны и уравнения для 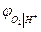 и
и 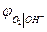 . Это объясняется термодинамической зависимостью активности
. Это объясняется термодинамической зависимостью активности 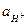 и
и 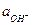 через константу диссоциации воды
через константу диссоциации воды 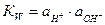 (ионное произведение воды).
(ионное произведение воды).
Окислительно-восстановительные (редокс) электроды. Это электроды, составленные из инертного металла (обычно платины), погруженного в раствор, где присутствуют ионы какого-либо вещества, имеющие различную степень окисления. В этом случае реакции окисления – восстановления идут без образования новой фазы.
Множество разнообразных редокс-электродов можно разделить на два класса:
а) не зависящие от рН раствора. К ним относятся некоторые неорганические окислительно – восстановительные системы:
Fe3+, Fe2+ | Pt Fe3+ + e → Fe2+
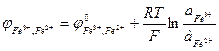
б) зависящие от рН раствора. К этой группе относятся часть неорганических и все органические системы.
Н+, MnO4-, Mn2+ | Pt MnO4- +8H+ + 5e → Mn2+ + 4H2O
H+, HCOOH, HCOH | Pt HCOOH+2H+ + 2e → HCOH + H2O
Дата добавления: 2016-06-22; просмотров: 3102;











