Типы гальванических элементов
Электрохимические цепи обычно классифицируют по двум признакам:
1) по источнику электрической энергии они делятся на химические и концентрационные;
2) по наличию или отсутствию в цепи границы двух различных растворов (а значит и диффузионного потенциала) на цепи с переносом или без переноса соответственно.
В химических цепях источником электрической энергии является химическая реакция, протекающая в электрохимической системе. Химические цепи могут быть с переносом (имеется граница двух растворов или соединение через солевой мостик) и без переноса, где такой границы нет. Химические цепи построены из электродов различных по химической природе. Знаки электродов в данной цепи определяются по величине 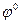 (из справочника).
(из справочника).
В качестве примера химической цепи с переносом является следующая цепь:
(-) Cu | CuSO4 l AgNO3 | Ag (+)
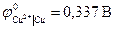
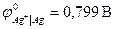
В данной цепи серебряный электрод является более положительным, и ему приписывается знак «+», а медному электроду «-». Реакции идущие на электродах:
Cu – 2e → Cu2+ 2Ag+ + 2e → 2Ag
Суммарная реакция
Cu + 2Ag+ → 2Ag + Cu2+
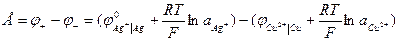
Примеры цепей без переноса:
Pt, H2 | HCl | Cl2, Pt
Pt, Cl2 | KCl | AgClТВ, Ag
В концентрационных цепях источником энергии является величина ∆G, обусловленная различными активностями одних и тех же химических компонентов.
В концентрационных цепях оба электрода идентичны как по физической природе, так и по химической природе участников окислительно–восстановительных процессов. Они отличаются только концентрациями компонентов. Знаки электродов определяются по реакциям на электродах, приводящим к выравниванию концентраций (активностей) веществ электродов.
Различают концентрационные цепи с переносом и без переноса.
Цепи без переноса строят из двух амальгамных электродов с разной концентрацией амальгам, сплавов или двух газовых электродов с разными давлениями газов, погруженных в один и тот же раствор. В этих цепях на электроде с большей концентрацией амальгамы, сплава или с большим давлением газа происходит ионизация атомов металла или газа, активность металла или газа уменьшается. На электроде с меньшей концентрацией будет происходить образование свободных атомов металла или молекул газа, их активность возрастает. Таким образом, в результате работы концентрационной цепи происходит выравнивание активностей компонентов на обоих электродах. Как и в химических цепях, электрод, на котором идет восстановление (присоединение электронов), будет положительным, где окисление – отрицательным. В качестве примера рассмотрим амальгамную цепь:
(-) Zn(Hg) | ZnSO4 | Zn(Hg) (+)
a1 a2 a1 > a2
В процессе выравнивания концентраций на левом электроде будет происходить растворение цинка по реакции:
Zn – 2e → Zn2+ (окисление)
На правом – образование цинка:
Zn2+ +2е → Zn (восстановление)
Значение ЭДС такой цепи:
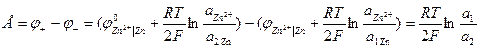
Концентрационные цепи с переносом – это электрохимические цепи с различной концентрацией растворов, в которые погруженгы электроды.
Например,
(-) Pt, H2 | HCl ll HCl | H2, Pt (+)
a1 < a2
В ходе работы этого элемента активности HCl должны выравниваться, т.е. а1 возрастать, а а2 убывать за счет реакций:
1/2Н2 – е → Н+ Н+ + е → 1/2Н2
Следовательно, правый электрод будет положительным, а левый – отрицательным.
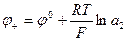
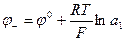
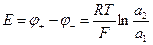
Дата добавления: 2016-06-22; просмотров: 3715;











