ЭЛЕКТРОДНЫЕ ПРОЦЕССЫ
При погружении металлического электрода в раствор, содержащий ионы этого же металла, устанавливается равновесие на границе металл - раствор. Разность химических потенциалов в растворе и электроде приводит к тому, что электрод растворяется и посылает ионы в раствор, если 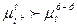 . Если же
. Если же 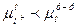 , то происходит осаждение катионов из раствора на электроде. Таким образом, на границе фаз образуется электрическая разность потенциалов, называемая гальвани – потенциалом.
, то происходит осаждение катионов из раствора на электроде. Таким образом, на границе фаз образуется электрическая разность потенциалов, называемая гальвани – потенциалом.
Экспериментальному определению доступна лишь электрическая разность потенциалов между точками, которые находятся в одинаковых по химическому составу фазах. Если же точки расположены в различных по химическому составу фазах, то электрическую разность потенциалов измерить невозможно. Такой разностью потенциалов между электродом и раствором является гальвани-потенциал.
Если же соединить два металлических электрода, погруженных в растворы, содержащие ионы этих металлов, тогда можно замерить разность потенциалов между этими электродами. При этом концы электрохимической цепи должны заканчиваться одинаковыми по своему составу металлами. Такая цепь называется правильно разомкнутой.

Рисунок 1 – Правильно разомкнутые электрохимические цепи
На практике это обычно достигается простым подключением медных проводов к обоим электродам (рисунок 1 б).
Электрохимическая цепь является равновесной, если процессы на электродах протекают бесконечно медленно.
Дата добавления: 2016-06-22; просмотров: 2995;











