Электродным потенциалом называют эдс электрохимической цепи, построенной из стандартного водородного электрода и электрода окислительно—восстановительной полуреакции.
Стандартный водородный электрод представляет собой платинированный платиновый электрод в растворе кислоты с активностью, равной единице, который омывается током водорода под давлением 1 атм. (1,013·105 Па), т.е. аН+ = 1; РН2 = 1. При записи электродного потенциала стандартный водородный электрод всегда располагается слева.
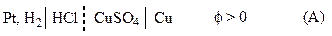
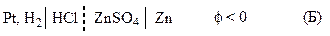
При обозначении электрода водородный электрод не записывается, а подразумевается, и запись электрода выглядит так:
CuSO4 | Cu
ZnSO4 | Zn
Знак электродного потенциала определяется знаком эдс при движении электронов от левого электрода (водородного) к правому. Если этот процесс самопроизволен, ∆G<0, то 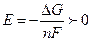 , значит и
, значит и 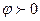 .
.
Электродный потенциал нередко обозначается знаком Е. Мы принимаем обозначение 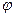 , чтобы различать электродный потенциал и эдс суммарной цепи.
, чтобы различать электродный потенциал и эдс суммарной цепи.
Величины электродных потенциалов зависят от концентрации всех компонентов, участвующих в окислительно-восстановительной полуреакции. Зависимость эта выражается уравнением Нернста. Так, величина электродного потенциала Си2+ 1 Си равна эдс цепи, где протекает реакция:
Н2 + Сu2+ → Сu + 2Н+
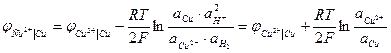
В общем случае уравнение Нернста для электродного потенциала имеет вид :
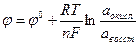 (2)
(2)
где аокисл, авосст - активности окисленных и восстановленных форм участников реакции.
Если активности участников полуреакции равны единице, то эдс цепи типа (А) и (В) будет называться стандартным электродным потенциалом. Величина стандартного водородного электрода равна нулю.
Дата добавления: 2016-06-22; просмотров: 2486;











