ИЗОТЕРМЫ ХИМИЧЕСКОЙ РЕАКЦИИ
Скорость и полнота химической реакции определяются химическим сродством реагирующих веществ. Степень химического сродства зависит от величины максимальной работы, которая для изохорно-изотермической реакции определяется разностью изохорных потенциалов 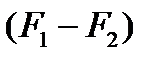 , а для изобарно-изотермической - разностью изобарных потенциалов
, а для изобарно-изотермической - разностью изобарных потенциалов 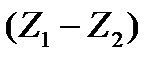 . Чем
. Чем
большее значение имеет максимальная работа реакции, тем больше химическое сродство реагентов. Тем полнее в этом случае проходит реакция и тем меньше остается к моменту равновесия исходных веществ и тем больше продуктов реакции.
Из анализа формулы (13.44) можно заключить, что константа равновесия с увеличением полноты реакции уменьшается. Отсюда следует, что константа равновесия связана с максимальной работой определенной зависимостью.
Уравнение, связывающее две эти величины, называется уравнением изотермы химической реакции.
Для вывода этого уравнения рассмотрим обратимую реакцию вида
aA+bB cC+dD.
В состоянии равновесия парциальные давления делаются равновесными и равными 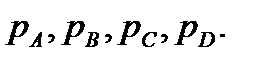 Изменение изобарно-изотермического потенциала находится по формуле (13.42). Подставляя в эту формулу значения химических потенциалов, определяемых уравнением (13.40), получим
Изменение изобарно-изотермического потенциала находится по формуле (13.42). Подставляя в эту формулу значения химических потенциалов, определяемых уравнением (13.40), получим
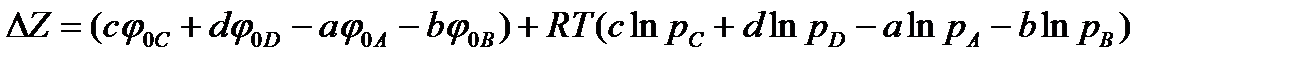 .
.
Учитывая (13.43), найдем
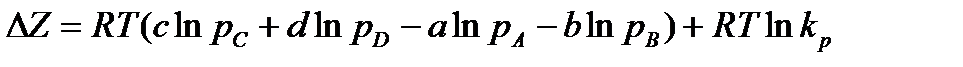 . (13.46)
. (13.46)
Полученное уравнение называется уравнением изотермы химической реакции. Его вывод как для изобарно-изотермических, так и для изохорно-изотермических реакций одинаков. Анализ этого уравнения позволяет сделать следующие выводы:
1. Если 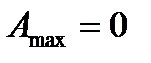 , то система находится в равновесии.
, то система находится в равновесии.
2. Если 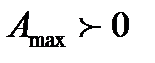 , то
, то 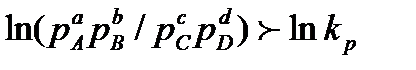 . Реакция в данном случае
. Реакция в данном случае
может идти только слева направо, т.е. с образованием веществ С и D.
3. Если 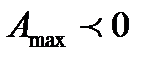 , то реакция может идти только справа налево, т.е. с образованием веществ A и В.
, то реакция может идти только справа налево, т.е. с образованием веществ A и В.
Уравнению изотермы химической реакции можно придать более простой вид, если отношение парциальных давлений принять равным единице, т.е.
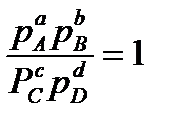
Тогда из (13.46) следует
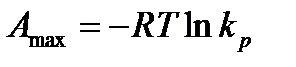 . (13.47)
. (13.47)
Или, учитывая, что R =8,3143 кДж/(моль.К) и переходя к десятичным логарифмам, получим
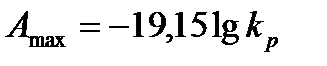 . (13.48)
. (13.48)
Дата добавления: 2016-06-05; просмотров: 2770;











