ЗАКОН ДЕЙСТВУЮЩИХ МАСС. КОНСТАНТЫ РАВНОВЕСИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
Соотношения (13.22), (13.25), (13.39), выведенные на основе второго закона термодинамики, позволяют установить условия химического равновесия. Рассмотрим газовую химическую реакцию для гомогенной системы
аА+ bB cC+dD,
где а, b, с, d- числа молей (стехиометрические коэффициенты) соответственно веществ А, В, С, D. Соотношение (13.39) можно записать в виде
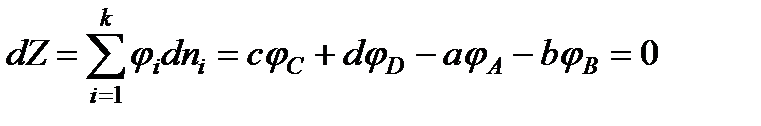 (13.42)
(13.42)
где 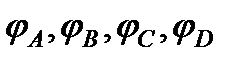 -химические потенциалы веществ А В, С, D при равновесии.
-химические потенциалы веществ А В, С, D при равновесии.
В случае идеальных газов значение химического потенциала компонентов определяется по формуле (13.40). На основе этой формулы можно записать
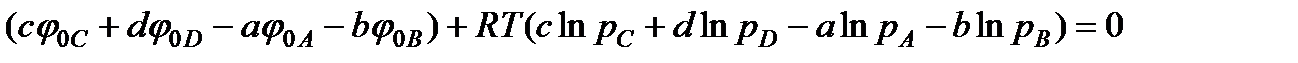 .
.
Отсюда
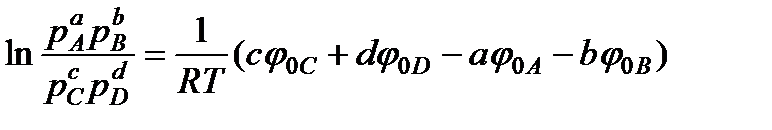 . (13.43)
. (13.43)
Ввиду постоянства правой части при определенной температуре левая часть также должна быть постоянной. Тогда, обозначая левую часть через 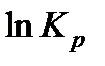 ,получим
,получим
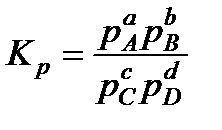 , (13.44)
, (13.44)
где Кр - константа равновесия химической реакции по парциальным давлениям.
Соотношение (13.44) является математическим выражением закона действующих масс. Подставляя (13.41) в (13.44), получим выражение константы химической реакции по концентрациям
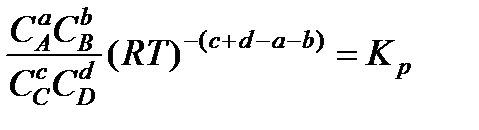
или
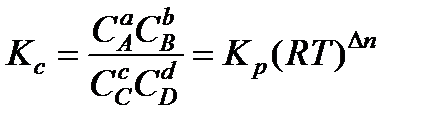 , (13.45)
, (13.45)
где 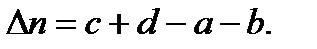
Для реакций, в которых не происходит изменение числа молей, Кc=Кp ,
так как 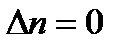 . Рассмотрим химическую реакцию вида
. Рассмотрим химическую реакцию вида
A + B C+D.
Выше было показано, что при определенных условиях скорость химической реакции определяется концентрациями реагирующих веществ. Скорости прямой и обратной реакций будут
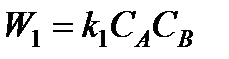 ;
; 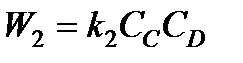 ,
,
где к1 и к2- константы скорости прямой и обратной реакций; CA , СB, СC ,CD - концентрации веществ в данный момент времени.
Рассмотрим более сложную реакцию, в которую входит равное количество молей веществ
аА+bВ сС + dD.
Скорости прямой и обратной реакции будут
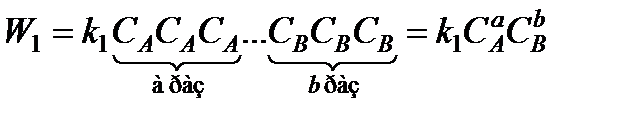 ;
;
Например, для реакции вида
CO+H2O CO2+H2
можно записать
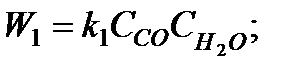
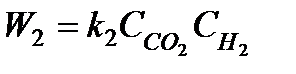 .
.
В процессе реакции скорость прямой реакции вследствие уменьшения концентрации исходных веществ будет уменьшаться, а скорость обратной - возрастать. В какой-то момент скорости будут равны 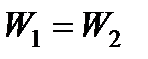 , и наступает химическое равновесие, являющееся динамическим, так как и прямая, и обратная реакции продолжают идти, но с равными скоростями.
, и наступает химическое равновесие, являющееся динамическим, так как и прямая, и обратная реакции продолжают идти, но с равными скоростями.
Приравнивая значения скоростей реакций, получим
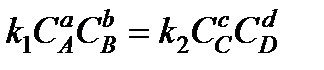 .
.
Отсюда
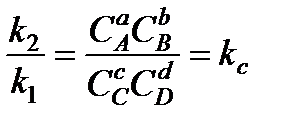 .
.
Закон действующих масс (см. уравнения (13.44), (13.45)), полученный для смеси идеальных газов, применим и к процессам диссоциации (разложения сложных веществ на более простые).
Дата добавления: 2016-06-05; просмотров: 2228;











