РАВНОВЕСИЕ В ХИМИЧЕСКИХ РЕАКЦИЯХ
Всякая химическая реакция обратима и может идти в двух направлениях - прямом и обратном, что обычно в химических уравнениях обозначается стрелками, т.е.
СО+Н2О С02+Н2.
Если в реакции количество реагирующих между собой молекул СО и Н2O больше количества реагирующих молекул СO2 и H2 , то реакция идет слева направо, т.е. в сторону образования продуктов реакции. В случае большего количества реагирующих молекул СO2 и Н2 реакция идет справа налево - в сторону образования исходных веществ.
Таким образом, направление реакции зависит от концентрации исходных веществ. Концентрацию вещества оценивают количеством молей в 1 м3, т.е.
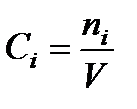
где Сi - концентрация i- го вещества; ni - число молей i - го вещества; V-объем.
В ходе реакции концентрация исходных веществ уменьшается, и скорость реакции можно определить по уменьшению концентрации того или иного исходного вещества в единицу времени. Скорость реакции определяется количеством молей вещества, прореагировавших в 1 м3 за 1 сек, т.е.
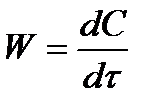
Концентрация газообразных продуктов реакции выражается через их парциальные давления. Из уравнения состояния идеального газа следует
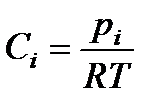 (13.41)
(13.41)
Химические реакции протекают до определенного состояния, называемого химическим равновесием, когда наряду с прямой реакцией образования ее продуктов идет обратная реакция образования исходных веществ. Важной практической задачей является определение параметров химического равновесия, что позволяет определить, в какую сторону оно сдвинуто, каков будет состав продуктов реакции и проч.
Дата добавления: 2016-06-05; просмотров: 1829;











