СИСТЕМАХ И ХИМИЧЕСКИХ РЕАКЦИЯХ
Допустим, что в изолированной термодинамической системе, состоящей из двух подсистем, вещество находится в двух различных фазах, причем количество вещества в подсистемах изменяется при неизменном общем количестве вещества в системе, т.е.
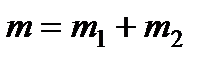 . (13.34)
. (13.34)
При постоянных температуре 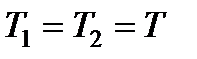 и давлении
и давлении 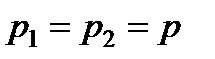 изобарно-изотермический потенциал в условиях равновесия должен иметь минимум, т.е.
изобарно-изотермический потенциал в условиях равновесия должен иметь минимум, т.е.
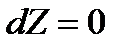 . (13.35)
. (13.35)
Ввиду аддитивности изобарно-изотермического потенциала
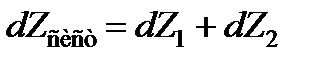 . (13.36)
. (13.36)
На основе соотношения (13.30)для 1-ой и 2-ой подсистем справедливы следующие равенства
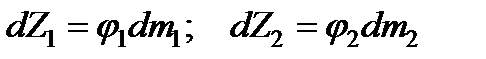 . (13.37)
. (13.37)
Подставляя (13.37)в (13.36)и учитывая, что в состоянии равновесия
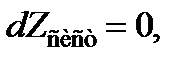 получим
получим
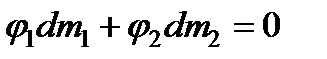 .
.
С учетом (13.34) 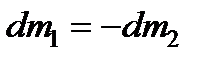 . Отсюда
. Отсюда
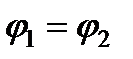
Таким образом, условия равновесия гетерогенной системы будут выполнены, если кроме равенства температур и давлений будет также выполнено условие равенства химических потенциалов фаз. А это означает, что в условиях равновесия удельные энергии в фазах равны.
Если число фаз больше двух, то в условиях равновесия при 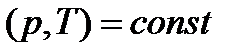
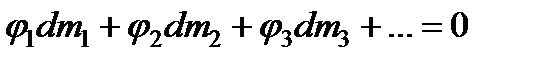
или
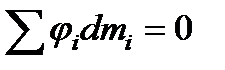 . (13.38)
. (13.38)
При равновесии в химических реакциях введение некоторого количества dni молей i-го компонента при сохранении постоянного количеств! молей всех других компонентов будет изменять значение изобарно-изотермического потенциала на величину
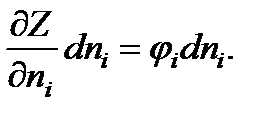
Отсюда уравнение
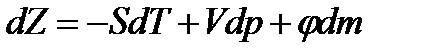
можно переписать в виде
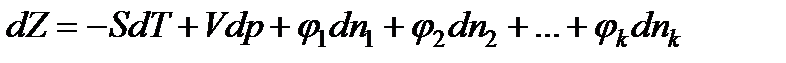
или
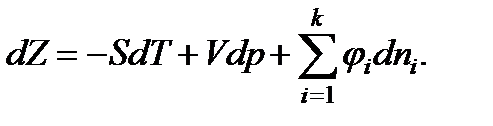
В условиях равновесия для химически реагирующих газов при 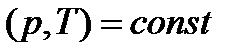
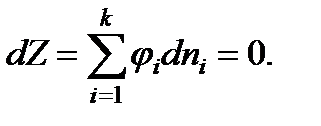 (13.39)
(13.39)
Формула химического потенциала i - го компонента при условии, что он является идеальным газом, записывается в виде
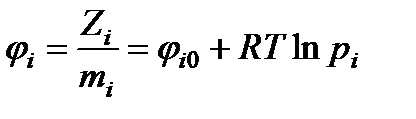 , (13.40)
, (13.40)
где Zi - парциальное значение изобарно-изотермического потенциала i-го компонента в смеси; φi0- значение химического потенциала i-го компонента,
не изменяющегося при постоянной температуре; pi- парциальное давление i - го компонента.
Дата добавления: 2016-06-05; просмотров: 2333;











