Реакции по функциональным группам радикала аминокислот
Радикалы отдельных аминокислот содержат функциональные группы, между которыми при сближении могут возникать слабые взаимодействия. Особенно важны такие взаимодействия при формировании пространственных структур белковых молекул.
Между радикалами аминокислот, а также между радикалами и пептидными группами пептидной связи могут возникать очень слабые водородные связи(рис. 5-4). Энергия этих связей невелика – 10-40 кДж/моль. Особенно они важны при формировании вторичных структур белков.

Рис. 5-4. Образование водородных связей
Ещё один вид слабых взаимодействий – это гидрофобные взаимодействия, которые возникают между неполярными гидрофобными радикалами аминокислот (рис. 5-5). К таким радикалам относятся группы СН3 аланина, бензольное кольцо фенилаланина, гетероциклический радикал триптофана и некоторые другие. Движущей силой возникновения таких связей является водное окружение полипептидной цепи, которое заставляет эти радикалы «прятаться» от воды внутрь. Особое значение они приобретают при формировании третичной структуры белков.
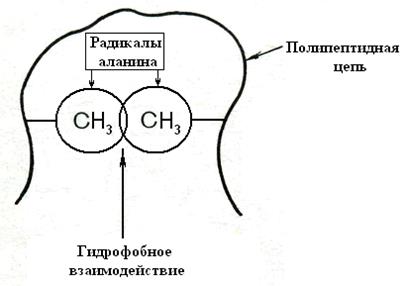
Рис. 5-5. Образование гидрофобных взаимодействий
Между радикалами аминокислот, содержащими ионогенные группы, возникает ионная (электростатическая) связь(рис. 5-6). К радикалам такого вида относятся радикалы аминокислот из двух групп – с радикалами, заряженными положительно, и с радикалами, заряженными отрицательно.
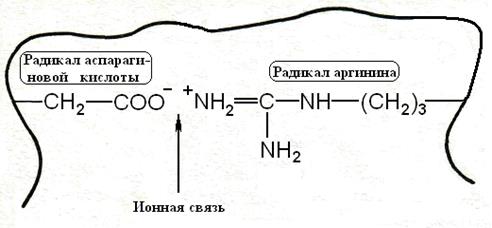
Рис. 5-6. Образование ионных связей
Между тиольными группами (SH-группы) аминокислоты цистеина может возникать ковалентная дисульфидная связь или мостик, которая так же, как гидрофобные взаимодействия, имеет большое значение для образования третичной структуры белков (рис. 5-7). Особенностью этой связи является её способность разрываться под воздействием восстановителей и вновь возникать при окислении. Такое её качество используют, например, при химической завивке волос.
Дисульфидная связь – это единственная ковалентная связь между радикалами аминокислот в полипептидах. Она может возникать как внутри одной пептидной цепи (внутрицепочечная), так и между остатками цистеина в разных пептидных цепях (межцепочечная).

Рис. 5-7. Образование дисульфидного мостика
Пептиды и белки
· Основные определения
Пептиды – полимеры, состоящие из аминокислот, соединённых пептидными связями. В пептидных цепях различают два конца. Тот, на котором свободная аминогруппа называют N-концом, на котором свободная карбоксильная группа – С-концом(рис. 5-8). Все природные пептиды образуются, начиная с N-конца.
По количеству аминокислотных остатков пептиды делят на три группы:
I. Олигопептиды – содержат от двух до десяти остатков аминокислот в цепи (дипептиды, трипептиды, тетрапептиды и т.д.).
II. Полипептиды – содержат свыше 10 до 50 остатков аминокислот.
III. Белки – полипептиды, в состав которых входит свыше 50 остатков аминокислот, соединённых пептидными связями. Их молекулярная масса превышает 5-10 тысяч дальтон.
|
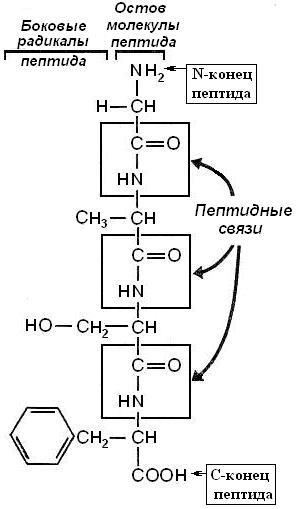
Рис. 5-8. Молекула тетрапептида
· Свойства пептидной связи
Пептидная связь – это основная связь во всех пептидах и белках. Её свойства обеспечивают прочность пептидного остова молекул. Чем это обусловлено?
 Основу пептидной связи составляет пептидная или амидная группа.
Основу пептидной связи составляет пептидная или амидная группа.
В конце 30-х годов XX века Л. Полинг и Р. Кори изучали пептидную связь с помощью рентгеноструктурного анализа. Они исследовали углы между связями в пептидной группе и длины связей между атомами С, О и N. В пептидной группе эти атомы образуют сопряжённую систему. В сопряжении участвуют электроны π-связи между атомами С и О и свободная электронная пара атома N. Поэтому связь между атомом углерода карбонильной группы и атомом азота имеет частично характер двойной связи.
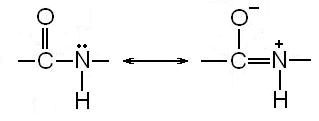
В результате сопряжения связь С—N становится короче (0,132 нм сравнительно с 0,147 нм в обычном случае), а связь С=О удлиняется до 0,124 нм против обычной длины 0,121 нм. Все три атома лежат в плоскости, образуя жесткую пептидную единицу. Вращение вокруг связи С—N поэтому заторможено, по сравнению с другими типами связей, образующих остов пептида (рис. 5-9).

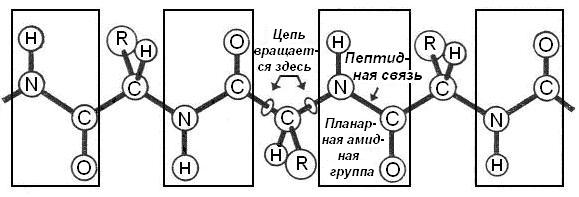
Рис. 5-9. Характеристики пептидной связи
Боковые радикалы α-углеродных атомов аминокислотных остатков расположены в транс-конфигурации относительно плоской пептидной структуры. В области между жесткими пептидными структурами имеется довольно высокая степень вращения.
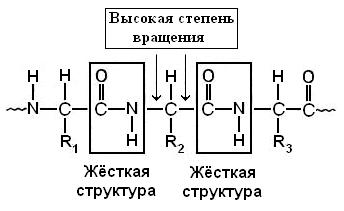
Исходя из структурных свойств пептидной связи, остов полипептидной цепи можно представить, как ряд плоскостей (рис. 5-10), соединённых между собой связями N—Сα и С—Сα. Вращение вокруг этих связей характеризуется углами φ и ψ, соответственно (рис. 5-11).
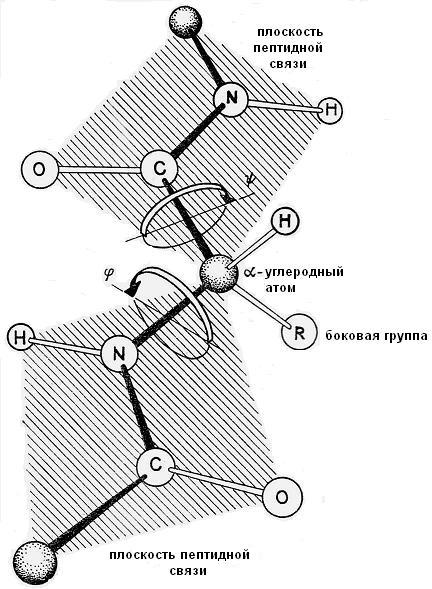
Рис. 5-10. Пептидная связь как сочетание плоскостей
|

Рис. 5-11. Расположение плоскостей пептидных связей под углами φ и ψ
Пептидные связи легко гидролизуются в кислой среде или под действием специфических ферментов пептидаз. Кислотный гидролиз белка можно провести при кипячении пептидов или белков в течение 24 час с 20% НСl.
· Биологические функции пептидов
1. Некоторые гормоны относятся к классу олиго- или полипептидов. Например, вазопрессин (гормон гипоталамуса) – октапептид, глюкагон (гормон поджелудочной железы) – полипептид из 29 остатков аминокислот.
2. Трипептид глутатион, состоящий из остатков глутаминовой кислоты, глицина и цистеина, регулирует окислительно-восстановительный статус клеток
3. Некоторые антибиотики относятся к олигопептидам, например, грамицидин S является циклическим декапептидом
4. Токсины некоторых рыб, змей, пауков и пчёл пептидной природы широко используют в фармацевтике или в аналитической биохимии. Например, тетродотоксин, яд рыбы фугу, применяют при изучении ионных каналов клеток.
· Классификация белков
Белки – это очень большая группа макромолекул, построенных из 20 аминокислот. Существует огромное множество вариантов последовательности аминокислот в полипептидной цепи белка. Кроме того, белки обладают очень разнообразными функциями. Поэтому не существует чёткой классификации белков по строению и составу молекул.
Обычно все белки разделяют на два больших класса по форме молекул – глобулярные и фибриллярные (рис. 5-12).
Глобулярные белки, в основном, хорошо растворимы в водных растворах солей (например, NaCl). Большинство из известных белков относятся к этой группе.
Фибриллярные белки – разнородная группа белков, которые состоят из одной или нескольких полипептидных цепей. Молекулы этих белков вытянуты, их длина в несколько раз превышает их диаметр. Из-за своей вытянутой формы эти белки, как правило, не растворяются в воде. Пример такого белка – это кератин кожи или волос. Однако среди фибриллярных белков есть и растворимые белки, например, белок крови фибриноген, несмотря на эллипсоидную структуру, хорошо растворяется в плазме крови.

Рис. 5-12. Форма белковых молекул
Второй тип классификации белков основан на их составе. Все белки можно поделить на те, что построены только из аминокислот, и те, в состав которых входит какая-либо небелковая часть (лиганд или простетическая группа). Белки, состоящие только из аминокислотных остатков, называют простыми белками. Например, к таким белкам относится гормон гипофиза соматотропин.
Белки с простетической группой называют сложными. В качестве лиганда в этих белках может быть:
1. углевод (гликопротеины),
2. липид (липопротеины),
3. металл (металлопротеины)
4. нуклеиновая кислота (нуклеопротеины)
5. гем (гемпротеины)
6. окрашенный компонент (хромопротеины)
7. витамин (витаминопротеины)
Примером широко известного сложного белка является гемпротеин гемоглобин, состоящий из четырёх полипептидных цепей. Простетическая группа в гемоглобине – сложная кольцевая структура с атомом железа в центре (рис. 5-13) .
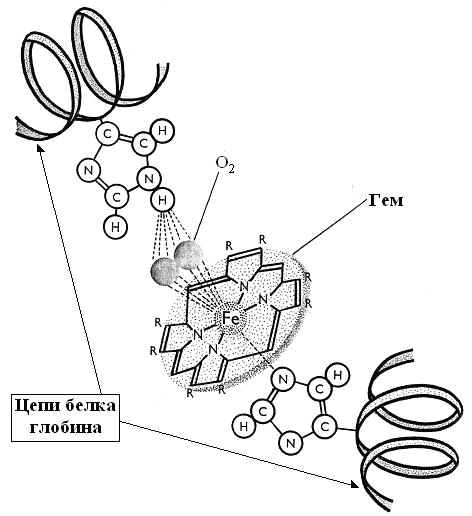
Рис. 5-13. Связь кофактора гема с белковыми цепями в молекуле гемоглобина
· Пространственная организация (конформация) белков
Длинные полипептидные цепи белков в пространстве приобретают определённую конформацию, специфичную для каждого конкретного белка. Такая организация белковой молекулы называется нативной конформацией и возникает она за счёт образования различных типов воздействий (кроме пептидных) между функциональными группами остатков аминокислот в цепи.
В понятие нативной конформации включают несколько уровней структурной организации молекулы.
1. Первичная структура белка – это последовательность аминокислотных остатков в полипептидной цепи молекулы, соединённых между собой пептидными связями.
Первичная структура каждого белка определяется генетическим аппаратом клетки. Она является самой прочной из всех структур, благодаря свойствам пептидной связи. Именно первичная структура будет определять формирование дальнейших структур белка и все его физико-химические свойства. В настоящее время расшифрована первичная структура очень многих белков (примеры на рис. 5-14 и 5-15).
|

|

Рис. 5-14. Аминокислотная последовательность в цепях рибонуклеазы и адренокортикотропного гормона
|

Рис. 5-15. Дисульфидные мостики в цепи рибонуклеазы
2. Вторичная структура белка – это регулярная структура цепи, которая образована периодически повторяющимися участками.
Такое регулярное расположение цепи в пространстве возникает и удерживается за счёт образования максимально возможного числа водородных связей между С=О и N–H группами в пептидных связях цепи.
Более характерна такая структура для фибриллярных белков, у которых она наблюдается по всей длине молекулы. У глобулярных белков определённая вторичная структура может возникать на отдельных участках молекулы (рис. 5-16), или не образуется вовсе.
|
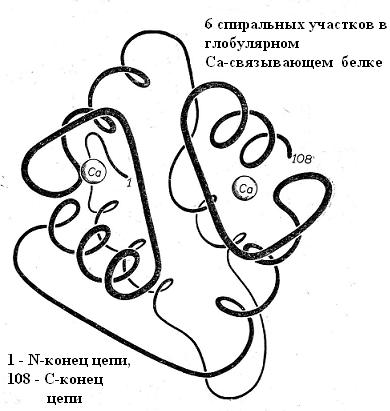
Рис. 5-16. Спирализованные участки в глобулярном Са-связывающем белке
Периодические регулярные структуры полипептидных цепей изучали Л.Полинг и Р. Кори с помощью рентгеноструктурных методов. В 1951 г. они предложили две периодические полипептидные структуры, называемые соответственно α-спираль и β-складчатый лист.
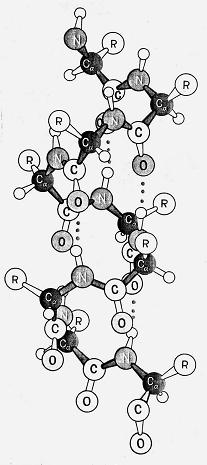
Одна из наиболее часто встречающихся вторичных структур – это α-спираль (рис. 5-17). Эта структура образуется с учётом геометрии пептидной связи и допустимыми изменениями углов φ и ψ. При скручивании полипептидной цепи в α-спираль на один её виток приходится 3,6 остатка аминокислот, шаг спирали равен ~0,54 нм. При образовании водородных связей С=О группа каждой аминокислоты соединяется с N–H группой аминокислоты, расположенной на 4 остатка впереди. Таким образом все С=О и N–Н группы соединены между собой водородными связями. Спираль может быть закручена по часовой стрелке (правая спираль) и против часовой стрелки (левая спираль). Наиболее выгодна правая α-спираль.
|

|
Рис. 5-17. Модель α-спирали полипептидной цепи
На рисунке 5-18 приведены параметры α-спирали. 18 остатков аминокислот составляют период повторяемости спиральной структуры. Он включает в себя 5 витков спирали с шагом спирали равным 0,54 нм и с углом подъёма спирали равным 26º.
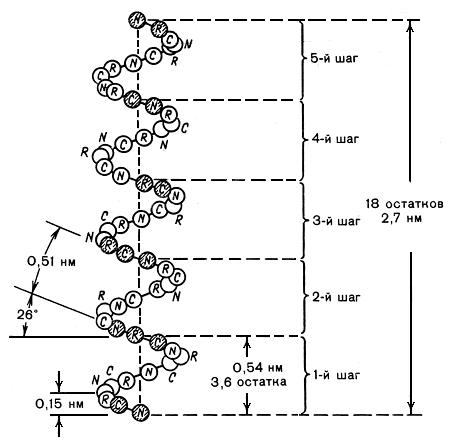
Рис. 5-18. Количественные характеристики α-спирали

Рис. 5-19. Суперспираль, образованная α-спиралями
В некоторых белках две или более α-спирали могут закручиваться одна вокруг другой образуя суперспираль (рис. 5-19). Такая структура обнаружена во многих белках: в кератине волос, миозине и тропомиозине мышц, эпидермисе кожи, сгустках крови.
Другой вид вторичной структуры – β-структура или складчатый лист (рис. 5-20). В отличие от стержневой формы α-спирали это плоская структура. Полипептидные цепи в β-слоях вытянуты и стабилизированы водородными связями между разными цепями, а не в пределах одной и той же цепи, как в α-спирали.
|

|

Рис. 5-20. Схема β-структуры (складчатый слой)
Может быть два вида складчатой структуры. В одном – полипептидные цепи расположены параллельно, т.е. аминокислотные последовательности во всех них начинаются с N-конца и идут к С-концу. Во втором виде цепи располагаются антипараллельно. Аминокислотные последовательности в них направлены в противоположные стороны. Например, белок шёлка фиброин образован антипараллельными слоями полипептидных цепей.
Некоторые аминокислоты, такие как глутаминовая кислота, пролин, аспарагин, гистидин, серин, лизин, дестабилизируют структуру складчатого листа.
В глобулярных белках β-структура может встречаться на отдельных фрагментах в пределах одной полипептидной цепи, когда она изгибается и образует несколько параллельных слоёв (рис.5-21).
|

Рис. 5-21. Расположение α-спиральных участков и β-структур в глобулярном белке
Дата добавления: 2021-10-28; просмотров: 1197;











