Третичная структура белка.
Изучение конформации глобулярных белков с помощью рентгеноструктурного анализа показало, что она значительно сложнее конформации фибриллярных белков и не имеет пространственной ориентации.
Для описания трёхмерной структуры глобулярных белков пользуются понятием третичной структуры белка, под которой понимают компактное расположение полипептидной цепи в пространстве специфичное для каждого конкретного белка.
Первый белок, для которого выяснили третичную структуру, – это миоглобин мышц кашалота. Это небольшой белок с молекулярной массой 16700. Он содержит 153 аминокислотных остатков в одинарной полипептидной цепи, и гем, как небелковый лиганд. Изучал этот белок Дж. Кендрью с помощью рентгеноструктурного анализа.
Белок представляет собой клубок с восемью α-спиральными участками, разделённых между собой местами сгибов (рис. 5-22).
Сейчас изучена третичная структура нескольких сотен белков. Она зависит от ионной силы, рН, температуры раствора, в которой белок находится, и других показателей.
Третичную структуру стабилизируют в основном нековалентные взаимодействиями между функциональными группами радикалов аминокислотных остатков в полипептидной цепи (рис. 5-23). К ним относятся гидро-
|
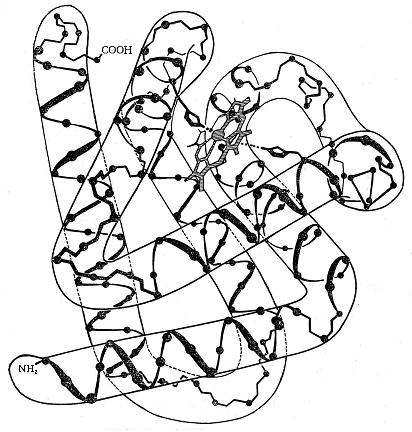
Рис. 5-22. Глобула миоглобина
фобные, водородные, диполь-дипольные и электростатические связи. В местах изгибов цепи возникают ковалентные дисульфидные мостики между радикалами цистеина.
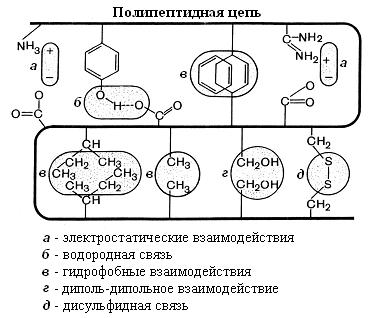
Рис. 5-23. Связи, стабилизирующие третичную структуру белков
Основной движущей силой в возникновении третичной структуры белков является взаимодействие радикалов аминокислот с молекулами воды. При этом гидрофобные радикалы погружаются внутрь возникающего клубка, образуя там сухие зоны, а полярные (гидрофильные) радикалы ориентируются наружу, в сторону воды. В результате возникает наиболее термодинамически выгодная конформация молекулы, обладающая минимальной свободной энергией.
Суммируя можно выделить следующие основные особенности третичной структуры миоглобина:
v молекула настолько компактна, что внутри помещается не больше 4 молекул воды;
v все полярные радикалы аминокислот расположены на внешней поверхности глобулы и гидратированы;
v почти все гидрофобные радикалы защищены от контакта с водой, так как расположены в глубине молекулы.
С помощью рентгеноструктурного анализа были исследованы и другие одноцепочечные белки и на рисунке 5-24 приведены модели их структур. На моделях видны отдельные спиральные участки, а также фрагменты с β-складчатой структурой.
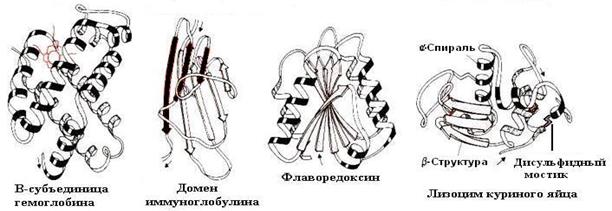
Рис. 5-24. Модели третичной структуры различных белков
4. Четвертичная структура белков – наиболее сложно организованная структура, характерная не для всех белков.
Большинство глобулярных белков с молекулярной массой больше 50000 Да представляют собой олигомерные структуры, т.е. они состоят из двух или более отдельных полипептидных цепей.
Для таких белков способ расположения в пространстве отдельных полипептидных цепей и формирование единого в структурном и функциональном отношении макромолекулярного образования (нативной конформации) называется четвертичной структурой.
Отдельные полипептидные цепи могут обладать одинаковой или разной первичной, вторичной и третичной структурами и называются протомерами или мономерами белковой молекулы. Сформированное ими образование называется мультимером или олигомером.
Протомеры соединяются друг с другом только нековалентными связями (аналогичными связям в третичной структуре). Каждый протомер в отдельности, как правило, не обладает биологической активностью, и она возникает только при определённом соединении мономеров. Число протомеров в белке чаще всего чётное (2, 4, 6, 8 или больше) (рис. 5-25).
|

Рис. 5-25. Модель белка-тетрамера
Одним из первых изученных белков с четвертичной структурой является гемоглобин. Он состоит из четырёх полипептидных цепей двух разных типов (α и β) и содержит 4 содержащих железо кофактора (гем) (рис. 5-26).
|

Рис. 5-26. Модель гемоглобина
Молекулярная масса таких сложных белков может достигать 100000 Да, хотя есть и более сложные образования как например нуклеопротеиновый комплекс вируса табачной мозаики. Его молекулярная масса – 40 млн Да, количество белковых протомеров нанизанных на цепь РНК – 2130. Весь гигантский нуклеопротеиновый комплекс образуется спонтанно методом самосборки (рис. 5-27). Даже если с помощью специальных методов разъединить молекулу РНК и полипептидные протомеры, то они полностью восстановят исходную структуру при последующем их смешивании.
|
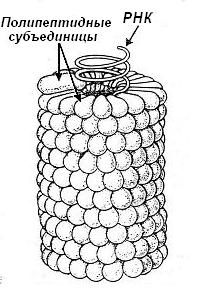
|

Рис. 5-27. Схема строения и процесса самосборки рибонуклеопротеинового комплекса вируса табачной мозаики
Нековалентные связи в олигомерной структуре образуются между контактными площадками отдельных мономеров, которые взаимодействуют друг с другом по принципу комплементарности. Формирование белков в виде сложных комплексов имеет ряд преимуществ:
v уменьшается вероятность ошибок при синтезе белка;
v экономится генетический материал, на основе которого идёт синтез;
v становятся возможными регуляторные взаимодействия, как в случае регуляторных ферментов.
· Физико-химические свойства белков
Дата добавления: 2021-10-28; просмотров: 584;











