Кислотно-основные свойства аминокислот (Аминокислоты как электролиты)
Аминокислоты – это кристаллические вещества хорошо растворимые в воде. Кристаллические аминокислоты плавятся при сравнительно высоких температурах (обычно выше 200˚C).
 Из этих свойств можно сделать вывод, что аминокислоты кристаллизуются из нейтральных растворов в виде биполярных ионов, которые называют цвиттерионами. Поэтому, в кристаллической решётке, состоящей из молекул аминокислот, возникают электростатические взаимодействия между противоположно заряженными группами, что стабилизирует кристалл. Значит, для того чтобы расплавить кристаллы, необходима дополнительная энергия, используемая для разрыва электростатических связей.
Из этих свойств можно сделать вывод, что аминокислоты кристаллизуются из нейтральных растворов в виде биполярных ионов, которые называют цвиттерионами. Поэтому, в кристаллической решётке, состоящей из молекул аминокислот, возникают электростатические взаимодействия между противоположно заряженными группами, что стабилизирует кристалл. Значит, для того чтобы расплавить кристаллы, необходима дополнительная энергия, используемая для разрыва электростатических связей.
Хотя для удобства аминокислоты часто изображают в виде незаряженных молекул, в растворах все они существуют в форме разных ионов и заряд ионов зависит от рН раствора.
Разберём это сначала на примере аминокислоты в общем виде.
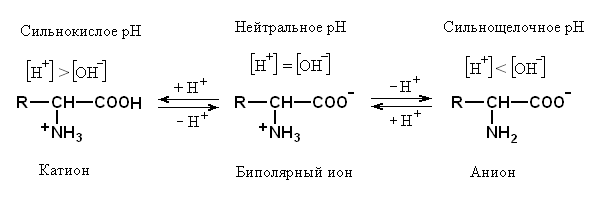
Если же брать аминокислоту с определёнными боковыми цепями, то заряд иона будет зависеть от наличия в радикале дополнительных кислотно-основных групп. Если в боковой цепи будет дополнительная кислотная группа, то образование формы биполярного иона сместится от нейтрального рН в более кислую сторону.
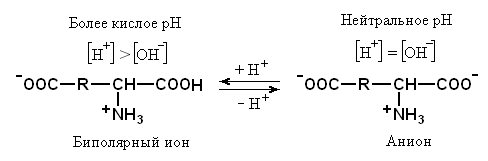
При наличие в боковой цепи основной группы биполярный ион будет преобладать при более щелочном значении рН.
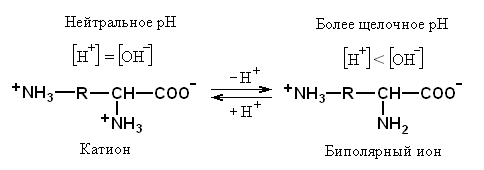
7. Понятие изоэлектрической точки аминокислоты (рΙ)
Изоэлектрическая точка аминокислоты – это такое значение рН раствора, при котором преобладающей формой будет биполярный ион аминокислоты. В электрическом поле такой ион не будет перемещаться ни к аноду, ни к катоду. То, что аминокислоты могут быть заряжены по-разному, используется в электрофорезе – методе разделения смеси аминокислот в соответствие с их зарядом при определённом значении рН буферного раствора.
Дата добавления: 2021-10-28; просмотров: 529;











