Растворимость белков
Глобулярные белки различаются по своей растворимости в воде. Существенное влияние на растворимость оказывают рН, температура и свойства растворителя. Обычно растворимость белков минимальна при значении рН, которое совпадает с изоэлектрической точкой белка. В изоэлектрической точке молекулы белка не несут заряда, и между соседними молекулами отсутствует электростатическое отталкивание. Если рН станет больше или меньше рI у всех молекул белка будет заряд одного знака, поэтому они отталкиваются друг от друга и слипание их в крупные нерастворимые агрегаты становится невозможным.
Кроме того, растворимость белка зависит от образования гидратной оболочки вокруг гидрофильных групп белковых молекул. Такая оболочка возникают, если у белковой молекулы сформирована гидрофильная поверхность (рис. 5-33).
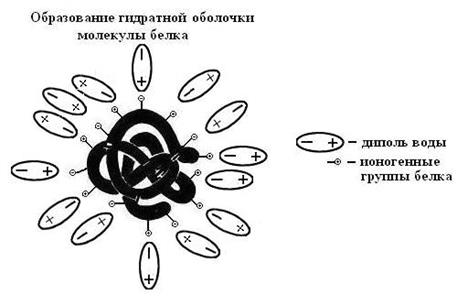
Рис. 5-33. Гидратная оболочка глобулярного белка
Высаливание белков
На растворимость глобулярных белков заметно влияют нейтральные соли (соли щелочных и щелочноземельных металлов и соли аммония). Высокие концентрации таких солей приводят к осаждению белков из водных растворов. Такое явление называется высаливанием. Наиболее эффективно высаливание в изоэлектрической точке белка.
Механизм высаливания заключается в том, что ионы растворённой соли притягивают диполи воды, уменьшая объём гидратной оболочки белка.
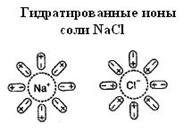
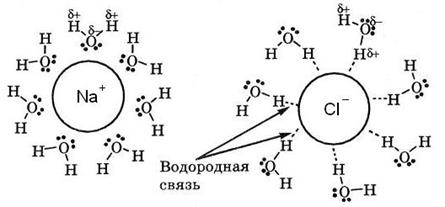
Рис. 5-34. Гидратирование ионов при растворении соли
 При определённой концентрации соли белковые молекулы утрачивают эту оболочку и, образуя крупные агрегаты, выпадают в осадок.
При определённой концентрации соли белковые молекулы утрачивают эту оболочку и, образуя крупные агрегаты, выпадают в осадок.
Важным является то, что осадок высоленного белка – это неповреждённые, нативные белковые молекулы. Удалив из осадка ионы соли с помощью диализа через полупроницаемую мембрану (рис. 5-35), можно опять растворить белок.
Рис. 5-35. Схема диализа через полупроницаемую мембрану
Денатурация белков
Денатурация белка – это такие изменения структуры молекулы, результатом которых будет осаждение белка из раствора и потеря им биологической активности. Под действием денатурирующих факторов в молекуле белка разрушаются нековалентные взаимодействия, которые формируют и поддерживают высшие уровни структуры (четвертичную, третичную и вторичную). Первичная структура денатурированного белка сохраняется.
Денатурацию вызывают различные химические и физические факторы. К ним относятся тепло, ультрафиолетовое излучение, органические растворители, мочевина, солянокислый гуанидин, кислоты, щёлочи и т.д.
Большинство белков денатурируют при нагревании растворов выше 50-60ºС, однако существуют и термоустойчивые белки, способные выдержать более сильное нагревание.
При непродолжительном действии и быстром устранении денатурирующего агента возможен обратный процесс – ренатурация белка с восстановлением исходной структуры и биологической активности (рис. 5-36). Ренатурацию можно наблюдать при действии на раствор белка мочевины, но при тепловой денатурации ренатурация белка невозможна.

Рис. 5-36. Денатурация–ренатурация белковой глобулы
Дата добавления: 2021-10-28; просмотров: 791;











