Уравнение Шредингера для атома водорода. Векторная модель атома.
Вопрос 1. Волновая функция и ее статистический смысл. Условие нормировки волновой функции. 

Как известно, основная задача классической механики заключается в определении положения макрообъекта в любой момент времени. Для этого составляется система уравнений, решение которой позволяет выяснить зависимость радиус-вектора 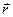 тела (материальной точки) от времени t. В классической механике состояние частицы при ее движении в каждый момент задается двумя величинами: радиус-вектором
тела (материальной точки) от времени t. В классической механике состояние частицы при ее движении в каждый момент задается двумя величинами: радиус-вектором 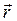 и импульсом
и импульсом 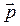 . Таким образом, классическое описание движения частицы правомерно, если оно происходит в области с характерным размером, много большим, чем длина волны де Бройля. В противном случае, например, вблизи ядра атома следует принимать во внимание волновые свойства микрочастиц. Об ограниченной применимости классического описания микрообъектов, имеющих волновые свойства, и говорят соотношения неопределенностей.
. Таким образом, классическое описание движения частицы правомерно, если оно происходит в области с характерным размером, много большим, чем длина волны де Бройля. В противном случае, например, вблизи ядра атома следует принимать во внимание волновые свойства микрочастиц. Об ограниченной применимости классического описания микрообъектов, имеющих волновые свойства, и говорят соотношения неопределенностей.
С учетом наличия у микрочастицы волновых свойств ее состояние в квантовой механике задается с помощью некоторой функции координат и времени 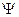 (x,y,z,t), называемой волновойили
(x,y,z,t), называемой волновойили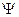 - функцией. В наиболее распространенной интерпретации эта функция связана с вероятностью обнаружения объекта в одном из чистых состояний (квадрат модуля волновой функции представляет собой плотность вероятности).
- функцией. В наиболее распространенной интерпретации эта функция связана с вероятностью обнаружения объекта в одном из чистых состояний (квадрат модуля волновой функции представляет собой плотность вероятности).
Отказавшись от описания движения частицы с помощью траекторий, получаемых из законов динамики, и определив вместо этого волновую функцию, необходимо ввести в рассмотрение уравнение, эквивалентное законам Ньютона и дающее рецепт для нахождения решения в частных физических задачах. Таким уравнением является уравнение Шрёдингера.
Теория, описывающая движение малых частиц с учетом их волновых свойств, называется квантовой, или волновой механикой. Многие положения этой теории кажутся странными и непривычными с точки зрения представлений, сложившихся при изучении классической физики. Следует всегда помнить, что критерием правильности теории, какой бы странной она не казалась поначалу, является совпадение ее следствий с опытными данными. Квантовая же механика в своей области (строение и свойства атомов, молекул и отчасти атомных ядер) прекрасно подтверждается опытом.
Волновая функция описывает состояние частицы во всех точках пространства и для любого момента времени. Для понимания физического смысла волновой функции обратимся к опытам по дифракции электронов. (Опыты Томсона и Тартаковского по пропусканию электронов через тонкую металлическую фольгу). Как отмечалось в предыдущей лекции, четкие дифракционные картины обнаруживаются даже в том случае, если направлять на мишень одиночные электроны, т.е. когда каждый последующий электрон испускается после того, как предыдущий достигнет экрана. После достаточной продолжительной бомбардировки картина на экране будет в точности соответствовать той, которая получается при одновременном направлении на мишень большого числа электронов.
Из этого можно сделать вывод о том, что движение любой микрочастицы по отдельности, в том числе и место ее обнаружения, подчиняется статистическим (вероятностным) закономерностям, и при направлении на мишень одиночного электрона точку на экране, в которой он будет зафиксирован, заранее со 100%-й уверенностью предсказать невозможно.
В дифракционных опытах Томсона на фотопластинке образовывалась система темных концентрических колец. Можно с уверенностью сказать, что вероятность обнаружения (попадания) каждого испущенного электрона в различных местах фотопластинки неодинакова. В области темных концентрических колец эта вероятность больше, чем в остальных местах экрана. Распределение электронов по всему экрану оказывается таким же, каким является распределение интенсивности электромагнитной волны в аналогичном дифракционном опыте: там, где интенсивность рентгеновской волны велика, частиц в опыте Томсона регистрируется много, а там, где интенсивность мала -- частицы почти не появляются.
С волновой точки зрения наличие максимума числа электронов в некоторых направлениях означает, что эти направления соответствуют наибольшей интенсивности волны де Бройля. Это послужило основанием для статистического (вероятностного) истолкования волны де Бройля. Волновая функция как раз и является математическим выражением, которое позволяет описать распространение какой-либо волны в пространстве. В частности, вероятность найти частицу в данной области пространства пропорциональна квадрату амплитуды волны, связанной с частицей.
Для одномерного движения (например, в направлении оси Ox) вероятность dP обнаружения частицы в промежутке между точками x и x+dx в момент времени t равна
dP = 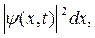 (21.1)
(21.1)
где | 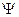 (x,t)|2=
(x,t)|2= 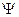 (x,t)
(x,t) 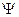 *(x,t) - квадрат модуля волновой функции (значок * обозначает комплексное сопряжение).
*(x,t) - квадрат модуля волновой функции (значок * обозначает комплексное сопряжение).
В общем случае при движении частицы в трехмерном пространстве вероятность dP обнаружения частицы в точке с координатами (x,y,z) в пределах бесконечно малого объема dV задается аналогичным уравнением: dP=| 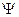 (x,y,z,t)|2 dV. Впервые вероятностную интерпретацию волновой функции дал Борн в 1926 г.
(x,y,z,t)|2 dV. Впервые вероятностную интерпретацию волновой функции дал Борн в 1926 г.
Вероятность обнаружить частицу во всем бесконечном пространстве равна единице. Отсюда следует условие нормировки волновой функции:
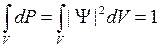 .(21.2)
.(21.2)
Величина 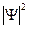 является плотностью вероятности, или, что то же самое, плотностью распределение координат частиц. В простейшем случае одномерного движения частицы вдоль оси ОX среднее значение ее координаты вычисляется следующим соотношением:
является плотностью вероятности, или, что то же самое, плотностью распределение координат частиц. В простейшем случае одномерного движения частицы вдоль оси ОX среднее значение ее координаты вычисляется следующим соотношением:
<x(t)> = 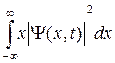 . (21.3)
. (21.3)
Чтобы волновая функция являлась объективной характеристикой состояния микрочастицы, она должна удовлетворять ряду ограничительных условий. Функция Ψ, характеризующая вероятность обнаружения микрочастицы в элементе объема, должна быть конечной (вероятность не может быть больше единицы), однозначной (вероятность не может быть неоднозначной величиной), непрерывной (вероятность не может меняться скачком) и гладкой (без изломов) во всем пространстве.
Волновая функция удовлетворяет принципу суперпозиции: если система может находиться в различных состояниях, описываемых волновыми функциями Ψ1, Ψ2 , … Ψn , то она может находиться в состоянии, описываемом линейной комбинацией этих функций:
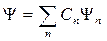 , (21.4)
, (21.4)
где Cn (n = 1, 2, 3…) – произвольные, вообще говоря, комплексные числа.
Сложение волновых функций(амплитуд вероятностей, определяемых квадратами модулей волновых функций) принципиально отличает квантовуютеорию от классической статистической теории, в которой для независимых событий справедлива теорема сложения вероятностей.
Волновая функция Ψ является основной характеристикой состояниямикрообъектов. Например, среднее расстояние < r > электрона отядра вычисляется по формуле:
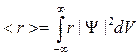 .
.
Таким образом, точно предсказать в дифракционных опытах, в каком месте экрана будет зафиксирован тот или иной электрон, невозможно, даже заранее зная его волновую функцию. Можно лишь с определенной вероятностью предположить, что электрон будет зафиксирован в определенном месте. В этом отличие поведения квантовых объектов от классических. В классической механике при описании движения макротел мы с достоверной вероятностью знали заранее, в каком месте пространства будет находиться материальная точка (например, космическая станция) в любой момент времени.
Де Бройль использовал представление о фазовых волнах (волнах вещества или волнах де Бройля) для наглядного толкования правила квантования орбит электрона в атоме по Бору в случае одноэлектронного атома. Он рассмотрел фазовую волну, бегущую вокруг ядра по круговой орбите электрона. Если на длине орбиты укладывается целое число этих волн 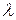 , то волна при обходе вокруг ядра будет всякий раз возвращаться в исходную точку с той же фазой и амплитудой. В этом случае орбита становится стационарной и не возникает излучения. Де Бройль записал условие стационарности орбиты или правило квантования в виде:
, то волна при обходе вокруг ядра будет всякий раз возвращаться в исходную точку с той же фазой и амплитудой. В этом случае орбита становится стационарной и не возникает излучения. Де Бройль записал условие стационарности орбиты или правило квантования в виде:
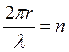 , (21.5)
, (21.5)
где r – радиус круговой орбиты, п – целое число (главное квантовое число). Полагая здесь 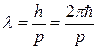 и учитывая, что p есть модуль имрульса, а L = rp есть модуль момента импульса электрона, получим:
и учитывая, что p есть модуль имрульса, а L = rp есть модуль момента импульса электрона, получим:
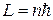 , (21.6)
, (21.6)
что совпадает с правилом квантования орбит электрона в атоме водорода по Бору. В дальнейшем условие (21.5) удалось обобщить и на случай эллиптических орбит, когда длина волны меняется вдоль траектории электрона. Однако, в рассуждениях де Бройля предполагалось, что волна распространяется не в пространстве, а вдоль линии – вдоль стационарной орбиты электрона. Этим приближением можно пользоваться в предельном случае, когда длина волны 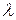 пренебрежимо мала по сравнению с радиусом орбиты электрона.
пренебрежимо мала по сравнению с радиусом орбиты электрона.
Дата добавления: 2017-10-04; просмотров: 1742;











