Электролитическая диссоциация
Электролиты – вещества, расплавы и растворы которых содержат подвижные ионы и проводят электрический ток.
Электролитическая диссоциация - процесс распада электролитов на ионы под действием растворителя (происходит вследствие электростатического взаимодействия вещества с полярными молекулами растворителя).
I. Теорию создал С. Аррениус, и он рассматривал диссоциацию как механический распад; ввел понятия «катион» и «анион».
II.Дополнил теорию И.А. Каблуков, доказав, что диссоциация - физико-химический процесс. Полярные молекулы растворителя способствуют лучшей диссоциации, т. к. окружают ионы в растворе, образуя довольно устойчивые частицы: «сольваты». Если растворитель - Н2О, то частицы называются «гидраты», и иногда при испарении растворов эти захваченные молекулы воды остаются в кристаллической решетке.
Степень диссоциации (a) - количественная мера способности вещества распадаться на ионы (экспериментально ее можно определить, например, исследуя электропроводность растворов):
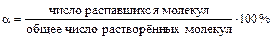 ,
,
a зависит от:
a) природы растворителя (чем он полярнее, тем a больше);
б)температуры (чем больше температура, тем a больше);
в)концентрации (чем меньше С, тем больше a);
г)от природы растворенных веществ.
По величине a все вещества можно поделить на 3 группы.
1. Сильные электролиты (a > 30%):
a) минеральные кислоты НС1, HBr, HI, HNO3, H2SO4, HCNS, HC1O4, HMnO4;
б) основания, образованные щелочными и щелочно-земельными металлами:
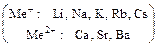
в)соли, помеченные в таблице растворимости буквой «р».
2. Слабые электролиты (a < 1-3%):
a) почти все органические кислоты;
б)минеральные кислоты H2S, Н2СОз, H2SiO3, HCN, Н2F2 ;
в)основания, образованные остальными металлами; NH4OH;
г)соли, помеченные в таблице растворимости буквами «м» и «н»;
д)Н2О
3. Средние электролиты (1 - 3% < a < 30%):
НСООН, HNO2, H2SO3, H3PO4, Mg(OH)2 и т. д.
Дата добавления: 2017-10-04; просмотров: 1655;











