Диссоциация кислот, оснований, солей. Диссоциация воды рН-показатель.
С помощью теории электролитической диссоциации дают определения и описывают свойства кислот, оснований и солей.
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода
Н3РО4  Н+ + Н2РО-4(первая ступень)
Н+ + Н2РО-4(первая ступень)
Н2РО-4  Н+ + НРO2-4 (вторая ступень)
Н+ + НРO2-4 (вторая ступень)
НРО2-4  Н+ PОЗ-4 (третья ступень)
Н+ PОЗ-4 (третья ступень)
Диссоциация многоосновной кислоты протекает главным образом по первой ступени, в меньшей степени по второй и лишь в незначительной степени по третьей. Поэтому в водном растворе, например, фосфорной кислоты наряду с молекулами Н3РО4 имеются ионы (в последовательно уменьшающихся количествах) Н2РО2-4,НРО2-4 и РО3-4.
Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы.
Например:
KOH  K+ + OH-; NH4OH
K+ + OH-; NH4OH  NH+4 + OH-
NH+4 + OH-
Основания, растворимые в воде называются щелочами. Их немного. Это основания щелочных и щелочноземельных металлов: LiOH, NaОН, КОН, RbОН, СsОН, FrОН и Са(ОН)2,Sr(ОН)2, Ва(ОН)2, Rа(ОН)2, а также NН4ОН. Большинство оснований в воде малорастворимо. Кислотность основания определяется числом его гидроксильных групп Например, NН4ОН - однокислотное основание, Са(ОН)2 - двухкислотное, Fе(ОН)3 -трехкислотное и т.д. Двух- и многокислотные основания диссоциируют ступенчато
Ca(ОН)2  Са(ОН)+ + OH- (первая ступень)
Са(ОН)+ + OH- (первая ступень)
Ca(OH)+  Ca2++OH- (вторая ступень)
Ca2++OH- (вторая ступень)
Однако имеются электролиты, которые при диссоциации одновременно образуют катионы водорода, и гидроксид-ионы. Эти электролиты называются амфотерными илиамфолитами. К ним относятся вода, гидроксиды цинка, алюминия, хрома и ряд других веществ. Вода, например, диссоциирует на ионы Н+ и ОН- (в незначительных количествах):
Н2O  Н+ + ОН-
Н+ + ОН-
Следовательно, у нее в равной мере выражены и кислотные свойства, обусловленны наличием катионов водорода Н+, и щелочные свойства,обусловленные наличием ионов ОН-.
Диссоциацию амфотерного гидроксида цинка Zn(ОН)2 можно выразить уравнением
2ОН- + Zn2+ + 2Н2О  Zn(ОН)2 + 2Н2О
Zn(ОН)2 + 2Н2О  [Zn(ОН)4]2-+ 2Н+
[Zn(ОН)4]2-+ 2Н+
Солями называются электролиты, при диссоциации которых образуются катионы металлов а также катион аммония ( NH+4) и анионы кислотных остатков
Например:
(NH4)2SO4  2NH+4 + SO2-4; Na3PO4
2NH+4 + SO2-4; Na3PO4  3Na+ + PO3-4
3Na+ + PO3-4
Так диссоциируют средние соли. Кислые же и основные соли диссоциируют ступенчато. У кислых солей вначале отщепляются ионы металлов, а затем катионы водорода. Например:
KHSO4  K+ + HSO-4
K+ + HSO-4
и далее
HSO-4  H++SO2-4
H++SO2-4
У основных солей вначале отщепляются кислотные остатки, а затем гидроксид-ионы.
Mg(OH)Cl  Mg(OH)++Cl-
Mg(OH)++Cl-
и далее
Mg(OH)+  Mg2++OH-
Mg2++OH-
Основностъ кислоты определяется числом катионов водорода, которые образуются при диссоциации. Так, НCl, HNO3 - одноосновные кислоты - образуется один катион водорода ;Н2S, Н2СО3, Н2SO4 - двухосновные, а Н3РО4, Н3АsО4 - трехосновные, так как образуются соответственно два и три катиона водорода. Из четырех атомов водорода,содержащихся в молекуле уксусной кислоты СН3СООН, только один, входящий в карбоксильную группу - СООН, способен отщепляться в виде катиона Н+, -уксусная кислота одноосновная.
Двух- и многоосновные кислоты диссоциируют ступенчато (постепенно).
В насыщенном растворе твердого электролита произведение концентраций его ионов есть величина постоянная при данной температуре. Она называется произведением растворимости.
ПР(CaSO4) = [Ca2+][SO42–]
Если молекула электролита содержит несколько одинаковых ионов, то концентрации этих ионов, согласно закону действия масс*, должны быть возведены в соответствующие степени. Например:
PbI2  Pb2+ + 2 I–
Pb2+ + 2 I–
ПР(PbI2) = [Pb2+][I–]2
Зная произведения растворимости, можно решать вопросы, связанные с образованием или растворением осадков при химических реакциях. Например, пусть диссоциация соли АВ происходит на два иона:
АВ  А+ + В–
А+ + В–
Обозначив растворимость через s (моль/л), получим [A+]=[B–]=s, ПР=[A+][B–]=s2. На практике чаще возникает обратная задача определения растворимости. Для соли, диссоциирующей на два иона, 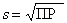 . Значения ПР можно найти в химических справочниках. Например,ПР(AgCl)=1,8·10–10, ПР(AgBr)=6·10–13, ПР(BaSO4)=1,1·10–10, ПР(HgS)=10–52. Если соль имеет общую формулу AB2, то она диссоциирует по уравнению:
. Значения ПР можно найти в химических справочниках. Например,ПР(AgCl)=1,8·10–10, ПР(AgBr)=6·10–13, ПР(BaSO4)=1,1·10–10, ПР(HgS)=10–52. Если соль имеет общую формулу AB2, то она диссоциирует по уравнению:
AB2  A2+ + 2 B–
A2+ + 2 B–
В этом случае [A2+]=s, [B–]=2s, ПР=[A2+][B–]2=s·(2s)2=4s3, 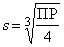 .
.
Если фактическое произведение концентраций (ПС) ионов в некотором растворе превышает значение произведения растворимости, т.е. ПС>ПР, то раствор является пересыщенным *, и из него выпадает осадок. Условие растворения осадка (ненасыщенности раствора): ПС<ПР. Оба процесса идут с одинаковой скоростью, и система приходит в состояние равновесия при ПС=ПР (насыщенный раствор).
Чистая вода обладает незначительной электрической проводимостью, которая объясняется небольшой диссоциацией воды на ионы водорода и гидроксид-ионы:
H2O  H+ + OH–
H+ + OH–
Такой процесс называется автопротолизом (самодиссоциацией). По величине электропроводности чистой воды можно вычислить концентрации ионов H+ и OH–. При 25°С они равны по 10–7 моль/л.
Выражение для константы диссоциации * воды имеет вид:
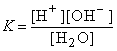 ,
,
откуда [H+][OH–]=K[H2O]=Kw .
В воде и разбавленных водных растворах концентрацию воды можно считать постоянной: [H2O]=55,5 моль/л, поэтому Kw – константа. Выражение, полученное для Kw, показывает, что в воде и разбавленных водных растворах при постоянной температуре произведение концентраций ионов водорода и гидроксид-ионов есть величина постоянная. Она называется ионным произведением воды. При 25°С Kw=10–14.
В кислых растворах больше концентрация ионов водорода, в щелочных – концентрация ионов OH–. Однако произведение этих молярныхконцентраций всегда остается постоянным. Если, например, к чистой воде добавить столько кислоты, чтобы концентрация ионов водорода повысилась до 10–3 моль/л, то концентрация гидроксид-ионов станет равной 10–11 моль/л. Следовательно, если известна величина [H+], то однозначно определяется величина [OH–]. Поэтому степень кислотности или щелочности раствора можно количественно охарактеризовать концентрацией ионов водорода:
Нейтральный раствор [H+]=10–7 моль/л;
кислый раствор [H+]>10–7 моль/л;
щелочной раствор [H+]<10–7 моль/л.
Наиболее часто используют не концентрацию [H+], а ее десятичный логарифм, взятый с обратным знаком:
pH= –lg [H+]
Эта величина называется водородным показателем. Например, если [H+]=10–5 моль/л, то pH=5; если [H+]=10–9 моль/л, то pH=9. Отсюда следует, что в нейтральном растворе pH=7, в кислом растворе pH<7, в щелочном растворе pH>7. Иногда пользуются значением гидроксидного показателя pOH=–lg[OH–]. При 25°С выполняется равенство: pH+pOH=14.
Для многих процессов величина pH очень важна (для жизнедеятельности растений и животных – pH крови, почвенного раствора). Свойства природных вод, в частности их коррозионная активность, сильно зависят от pH.
Дата добавления: 2016-06-22; просмотров: 4780;











